voi esteri sono composti organici ossigenati che si formano per reazione chimica tra a acido carbossilico è un alcol. Presentare il gruppo funzionale (composto da due atomi di ossigeno e due radicali R) rappresentato di seguito:
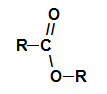
Gruppo funzionale generale di un estere
Strutturalmente, ciò che caratterizza il estere è la presenza di qualche radicale alchilico attaccato direttamente all'atomo di ossigeno. In questo caso, il radicale (R) attaccato al carbonio – che, a sua volta, è doppiamente legato all'ossigeno – può essere un radicale alchilico o un atomo di idrogeno.
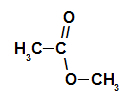
Catena carbonica di un estere
reazione di esterificazione
si tratta di reazione chimica che origina un estere e una molecola d'acqua dall'interazione tra un acido carbossilico e un qualsiasi alcol, come nell'equazione seguente:
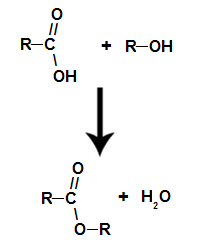
Equazione chimica che rappresenta la formazione di un estere
Durante l'esterificazione, il gruppo ossidrile (OH) dell'alcol interagisce con il idrogeno (H) ionizzabile dall'idrossile dell'acido e forma il molecola d'acqua.
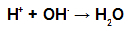
Molecole d'acqua che formano gruppi nell'esterificazione
già il estere si forma legando il radicale (R) dell'alcol con l'ossigeno, residuo dell'ossidrile dell'acido dopo la formazione dell'acqua.
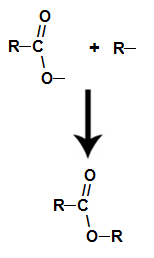
Formazione della molecola dell'estere
Caratteristiche degli esteri
Principali proprietà fisiche presentate da esteri:
Hanno aromi di frutta e fiori;
esteri bassi massa molare sono liquidi a temperatura ambiente e quelli con massa molare elevata sono solidi;
Rispetto agli alcoli e agli acidi carbossilici, gli esteri hanno punti di fusione e di ebollizione inferiori;
Rispetto all'acqua, gli esteri di massa molare inferiore sono meno densi;
Gli esteri di massa molare inferiore sono polari e quelli di massa molare superiore non sono polari;
Negli esteri polari predominano le forze dipolo permanente; nel non polare, le forze predominano dipolo indotto;
Gli esteri con massa molare inferiore sono scarsamente solubili in acqua e quelli con massa maggiore sono insolubili in acqua.
Una regola di denominazione dell'estere
Prima di usare la regola di denominazione di a estere, è fondamentale ricordare che questo composto è formato dall'unione di due parti, una proveniente da di acido carbossilico (in rosso) e l'altro di alcol (in blu), come rappresentato dall'immagine a Seguire:
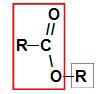
Identificazione delle parti che originano l'estere
Secondo l'Unione Internazionale di Chimica Pura e Applicata (IUPAC), la regola ufficiale per nominare un estere è:
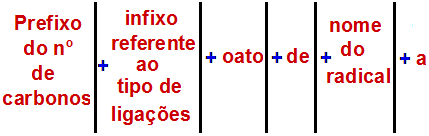
Una regola di denominazione dell'estere
Nota: Il prefisso e l'infisso corrispondono sempre alla parte dell'acido carbossilico e il radicale corrisponde alla parte dell'alcol.
Si vedano di seguito alcuni esempi di applicazione della regola di denominazione per gli esteri:
1° Esempio: essenza di lampone
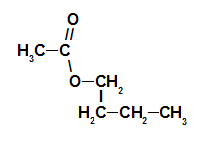
Formula strutturale dell'estere dell'essenza di lampone
Per denominare questo estere, usiamo:
N. Prefissooh di carboni: et, poiché l'acido formante ha due atomi di carbonio;
Infisso sul tipo di link: un, poiché l'acido formante ha solo singoli legami tra i carboni;
l'atto;
nel;
Radicale: butile, avendo quattro atomi di carbonio in sequenza;
Il.
Quindi, il nome dell'estere corrispondente all'essenza di lampone è etanoato di butile.
2° Esempio: essenza di pigna
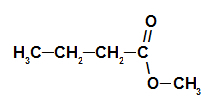
Formula di struttura dell'estere della pigna
Per formare il nome di questo estere usiamo:
N. Prefissooh di carboni: ma, poiché la formazione di acido ha quattro atomi di carbonio;
Infisso sul tipo di link: un, poiché l'acido formante ha solo singoli legami tra i carboni;
l'atto;
nel;
Radicale: metile, poiché l'alcol formante ha un solo carbonio;
Il.
Quindi, il nome dell'estere corrispondente all'essenza della pigna è butanoato di metile.
3° Esempio: essenza di fragola
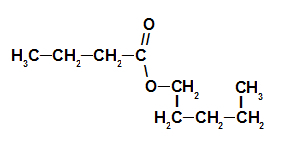
Formula strutturale estere di essenza di fragola
Per denominare questo estere, usiamo:
N. Prefissooh di carboni: ma, poiché l'acido formante ha quattro atomi di carbonio;
Infisso sul tipo di link: un, poiché l'acido formante ha solo singoli legami tra i carboni;
l'atto;
nel;
Radicale: pentile, poiché l'alcool formante ha cinque atomi di carbonio in sequenza;
Il.
Quindi, il nome dell'estere corrispondente all'essenza di fragola è butanoato di pentile.
Usi degli esteri
Gli esteri sono ben noti per il loro uso come aroma negli alimenti trasformati, cioè sostanze che simulano il sapore e l'aroma caratteristici degli alimenti naturali, come la frutta. Inoltre, gli esteri sono ancora utilizzati nella fabbricazione di medicinali, cosmetici, profumi e cere.
Di Me. Diogo Lopes Dias
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ester.htm

