Se fosse possibile visualizzare molto chiaramente la struttura di un metallo, lo vedremmo come nell'immagine sopra. La struttura atomica dei metalli è cristallina, costituita da cationi metallici circondati da elettroni.
I reticoli cristallini presenti nei metalli possono essere rappresentati come segue: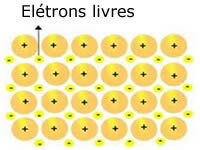
Rappresentazione del sodio metallico (Na)
I reticoli cristallini dei metalli sono formati da un gruppo di cationi fissi.
Ogni catione Na+ è circondato da elettroni, ma questi sono delocalizzati, cioè non sono attratti da nessun nucleo.
Non essendoci attrazione tra le cariche negative (elettrone) e il nucleo positivo (catione), gli elettroni liberi finiscono per occupare l'intero reticolo cristallino del metallo. La libertà che hanno gli elettroni di muoversi li fa formare una nuvola elettronica.
La capacità dei metalli di condurre elettricità è spiegata dalla presenza di questa nuvola. La corrente elettrica deriva dal contatto di elettroni liberi con altri metalli.
Nella composizione di qualsiasi atomo, inclusi metalli come Sodio (Na), Oro Au, Rame (Cu), c'è uno strato di valenza. Gli elettroni si muovono liberamente attraverso questo strato mantenendo l'attrazione elettromagnetica per i cationi. Questa proprietà strutturale consente la formazione di molecole metalliche e, di conseguenza, dei metalli stessi.
di Liria Alves
Laureato in Chimica
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/como-se-forma-ligacao-metalica.htm


