IL isomeria è un fenomeno osservato quando diversi composti sono formati da quantità uguali degli stessi tipi di atomi.
Pertanto, possiamo trovare sostanze chimiche con la stessa formula molecolare e diverse formule strutturali o disposizioni spaziali.
Questo fenomeno è ampiamente osservato in Chimica Organica, che studia i composti del carbonio. Poiché ogni atomo di questo elemento può formare 4 legami chimici, è possibile osservare diverse combinazioni.
Poiché il cambiamento nella disposizione degli atomi dà origine a nuove sostanze, di conseguenza, hanno proprietà fisiche e chimiche diverse.
Quando diciamo quali composti sono isomeri significa che hanno parti uguali, poiché la parola è una combinazione di due termini di origine greca: isos, significa "veramente", e semplice, che è "parti".
I due principali gruppi di isomeria sono il piano e lo spazio (stereoisomerismo).
IL isomeria piatta può essere visualizzato dalla formula strutturale piatta dei composti e ha cinque classi: posizione, funzione, catena, compensazione e tautomeria.
IL isomeria spaziale è osservato dall'orientamento dei composti ed è suddiviso in geometrico (cis-trans) e ottico.
Il concetto di isomeria fu introdotto nel 1830 dallo scienziato svedese Jacob Berzelius.
Esempi di isomeri
IL isomeria a catena si verifica quando lo stesso insieme di atomi si connette per formare strutture dello stesso gruppo funzionale, ma con catene diverse.
Esempio: la formula molecolare C4h10 di un idrocarburo può essere lineare o ramificato.

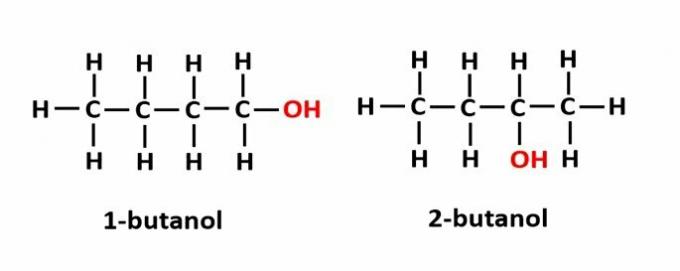
IL isomeria di posizione si verifica quando i composti sono formati dagli stessi gruppi funzionali, ma si trovano in posizioni diverse nella catena.
Esempio: la formula molecolare C4h9OH corrisponde a due tipi di alcol.
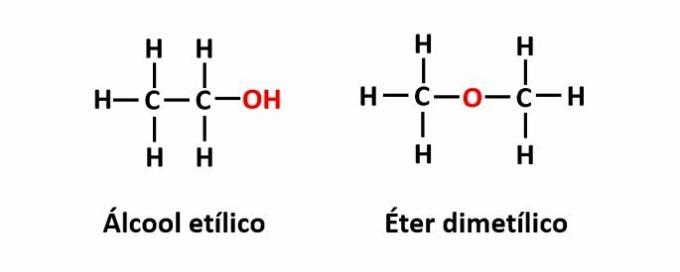
IL isomeria di funzione si verifica quando la stessa formula molecolare corrisponde a due composti con gruppi funzionali diversi.
Esempio: la formula molecolare C2h6O corrisponde a due isomeri che hanno le funzioni alcol (-OH) ed etere (-O-).
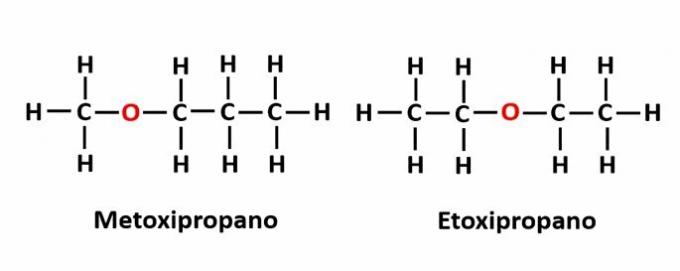
IL isomeria di compensazione si verifica quando c'è un eteroatomo nella catena e occupa posizioni diverse. Questo è un caso particolare di isomeria di posizione.
Esempio: la formula molecolare C4h10Il indica la presenza di un atomo di ossigeno nella catena, ma la sua posizione può cambiare e formare diversi composti.
IL isomeria dinamica, detta anche tautomeria, si verifica quando due composti con funzioni diverse si trovano nella stessa soluzione in equilibrio dinamico. Questo è un caso particolare di isomeria di funzione.
Esempio: la formula molecolare C2h4O corrisponde a composti con le funzioni aldeidica ed enolica.
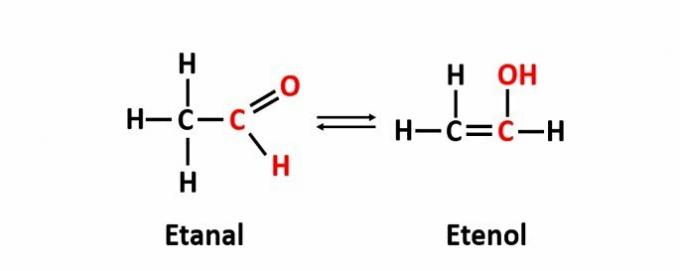
Impara di più riguardo isomeria piatta.
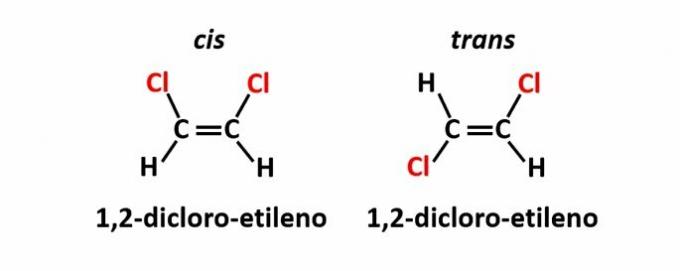
IL isomeria geometrica, chiamato anche isomeria cis-trans, si verifica quando la presenza di un doppio legame o di una struttura ciclica fa sì che ligandi uguali siano sullo stesso lato del piano (cis) o su lati opposti (trans).
Esempio: gli atomi di cloro nei composti di formula molecolare C2h2Cl2 possono avere due strutture spaziali.
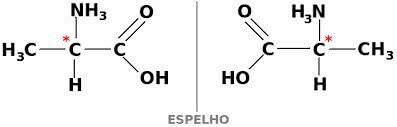
IL isomeria ottica si verifica quando, deviando la luce polarizzata emessa sulla struttura, i composti riescono a deviare il raggio luminoso a sinistra, se è un isomero levogiro (l), o a destra, quando è un isomero destrogiro (D).
Esempio: questo tipo di isomeria si verifica con l'acido lattico. Nota sotto che le immagini spettrali degli isomeri non si sovrappongono, quindi sono chiamati enantiomeri.
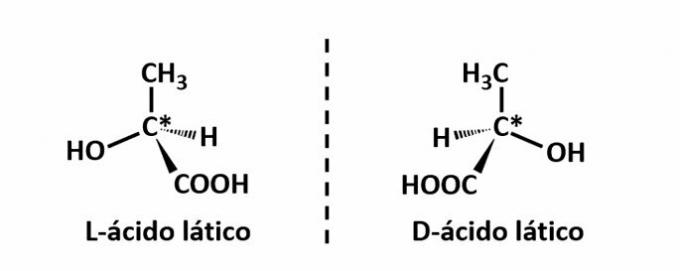
Il simbolo C* indica la presenza di un carbonio chirale in questa struttura, cioè un atomo di carbonio con 4 diversi linker.
Scopri di più sull'isomerismo con i contenuti:
- Tipi di isomeria
- isomero spaziale
- isomero geometrico
- isomero ottico
- Esercizi sull'isomerismo piano