L'isomerismo chimico è un fenomeno osservato quando due o più sostanze organiche hanno la stessa formula molecolare, ma struttura molecolare e proprietà diverse.
Le sostanze chimiche con queste caratteristiche sono chiamate isomeri.
Il termine deriva dalle parole greche iso = uguale e semplice = parti, cioè parti uguali.
Esistono diversi tipi di isomeria:
- isomero piatto: I composti sono identificati da formule strutturali piatte. È diviso in isomeria di catena, isomeria di funzione, isomeria di posizione, isomeria di compensazione e isomeria di tautomerismo.
- isomero spaziale: La struttura molecolare dei composti ha diverse strutture spaziali. Si divide in isomeria geometrica e ottica.
isomero piatto
A isomeria piatta o isomeria costituzionale, la struttura molecolare delle sostanze organiche è piatta.
I composti che presentano questa caratteristica sono chiamati isomeri piatti.
isomero di catena
L'isomerismo a catena si verifica quando gli atomi di carbonio hanno catene diverse e la stessa funzione chimica.
Esempi:
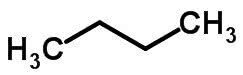
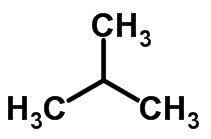
Isomeria di funzione
L'isomerismo di funzione si verifica quando due o più composti hanno funzioni chimiche diverse e la stessa formula molecolare.
Esempi: questo caso è comune tra aldeidi e chetoni.
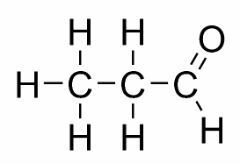
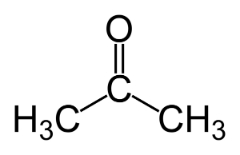
isomero di posizione
L'isomerismo di posizione si verifica quando i composti sono differenziati da diverse insaturazioni, ramificazioni o posizioni di gruppi funzionali nella catena del carbonio. In questo caso, gli isomeri hanno la stessa funzione chimica.
Esempi:

isomero di compensazione
L'isomerismo di compensazione o metamerismo si verifica in composti con la stessa funzione chimica che differiscono per la posizione degli eteroatomi.
Esempi:

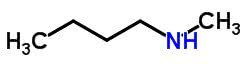
Tautomeria
Il tautomerismo o isomeria dinamica può essere considerato un caso specifico di isomeria di funzione. In questo caso, un isomero può trasformarsi in un altro modificando la posizione di un elemento nella catena.
Esempi:

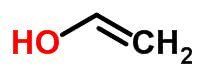
isomero spaziale
IL isomeria spaziale, chiamato anche stereoisomeria, si verifica quando due composti hanno la stessa formula molecolare e diverse formule di struttura.
In questo tipo di isomeria, gli atomi sono distribuiti allo stesso modo, ma occupano posizioni diverse nello spazio.
isomero geometrico
IL isomeria geometrica o cis-trans si verifica nelle catene aperte insature e anche nei composti ciclici. Per fare ciò, i ligandi di carbonio devono essere diversi.

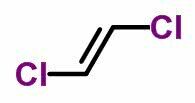
- Quando gli stessi ligandi sono sullo stesso lato, la nomenclatura degli isomeri riceve il prefisso cis.
- Quando gli stessi leganti sono su lati opposti, la nomenclatura riceve il prefisso trans.
La IUPAC (International Union of Pure and Applied Chemistry) raccomanda di utilizzare come prefisso le lettere Z ed E invece di cis e trans.
Questo perché Z è la prima lettera della parola tedesca zusammen, che significa "insieme". Ed è la prima lettera della parola tedesca entegen, che significa "opposta".
isomero ottico
IL isomeria ottica è dimostrato da composti otticamente attivi. Succede quando una sostanza è causata dalla deviazione angolare nel piano della luce polarizzata.
- Quando una sostanza piega la luce ottica a destra si chiama destrorsi.
- Quando una sostanza piega la luce ottica a sinistra, la sostanza viene chiamata levogiro.
Una sostanza può anche esistere in due forme otticamente attive, dextogyra e levogyra. In questo caso si chiama enantiomero.
Perché un composto di carbonio sia otticamente attivo, deve essere chirale. Ciò significa che i loro ligandi non possono sovrapporsi, essendo asimmetrici.
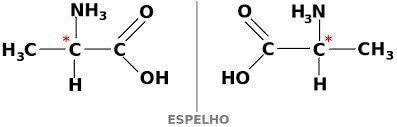
A loro volta, se un composto ha le forme destrogira e levogira in parti uguali, vengono chiamate miscele racemiche. L'attività ottica delle miscele racemiche è inattiva.
Leggi anche:
- Carbonio
- Chimica organica
- Formula molecolare
- formula strutturale
Esercizi
1. (Mackenzie 2012) Numerare la colonna B, che contiene i composti organici, associandoli alla colonna A, secondo il tipo di isomeria che ogni molecola organica presenta.
Colonna A
1. isomero di compensazione
2. isomero geometrico
3. isomero di catena
4. isomero ottico
Colonna B
( ) ciclopropano
( ) etossi-etano
( ) bromo-cloro-fluoro-metano
( ) 1,2-dicloro-etene
La corretta sequenza di numeri nella colonna B, dall'alto verso il basso, è
a) 2 - 1 - 4 - 3.
b) 3 - 1 - 4 - 2.
c) 1 - 2 - 3 - 4.
d) 3 - 4 - 1 - 2.
e) 4 - 1 - 3 - 2.
Alternativa b) 3 - 1 - 4 - 2.
2. (Uerj) L'isomeria è il fenomeno caratterizzato dal fatto che la stessa formula molecolare rappresenta strutture diverse.
Considerando l'isomerismo strutturale piatto per la formula molecolare C4H8, possiamo identificare isomeri dei seguenti tipi:
a) catena e posizione
b) catena e funzione
c) funzione e compensazione
d) posizione e compenso
Alternativa a) stringa e posizione
3. (OSEC) Propanone e isopropenolo esemplificano un caso di isomeria:
a) di metameria
b) di funzione
c) di tautomeria
d) cis-tran
e) catena
Alternativa c) di tautomeria
Vedi anche: Esercizi sull'isomerismo piatto


