La principale caratteristica distintiva delle reazioni redox è che contemporaneamente una specie chimica perde elettroni (per ossidazione) e un'altra ne acquista (per riduzione).
Tuttavia, in alcune reazioni è possibile osservare che non si ha solo ossidazione e/o riduzione. Di seguito è riportato un esempio:
SnS + HCl + HNO3 → SnCl4 + S + NO + H2oh
Calcolando i numeri di ossidazione (Nox) di tutti gli atomi in questa reazione, come insegnato nel testo “Determinazione del Numero di Ossidazione (Nox)”, abbiamo:
+2 -2 +1 -1 +1 +5 -2 +4 -1 0 +2 -2 +1 -2
SnS + HCl + HNO3 → SnCl4 + S + NO + H2oh
Controlliamo ora qualile sostanze subivano variazioni nel loro Nox e, di conseguenza, che ossidavano e riducevano:
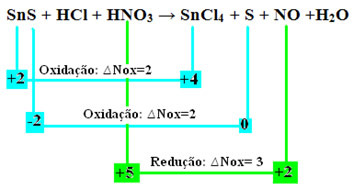
Notare che si sono verificate due ossidazioni. Quindi, in tal caso, come bilanciare l'equazione chimica?
Una cosa importante da tenere a mente che si applica a tutte le reazioni redox è che il numero di elettroni ceduti deve essere sempre uguale al numero di elettroni ricevuti.
Pertanto, per bilanciare questo tipo di reazione, seguire le stesse regole stabilite nel testo"
Bilanciamento redox”, tuttavia, con una sola modifica: la determinazione della variazione di Nox (∆Nox) della specie che ha generato le due ossidazioni (SnS) sarà la somma dei due ∆Nox, che ci darà il valore totale degli elettroni persi:- SnS: ∆Nox totale = (∆Nox SnCl4) + (∆Nox S)
SnS: ∆NOx totale = 2 + 2 = 4
- HNO3: Nox = 3
Quindi, possiamo procedere con i seguenti passaggi per il bilanciamento:
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
- SnS: ∆NOx totale = 4 → 4 sarà il coefficiente HNO3;
- HNO3: Nox = 3 → 3 sarà il coefficiente di SnS.
3 SnS + HCl + 4 HNO3 → SnCl4 + S + NO + H2oh
Continuando il bilanciamento per metodo di prova:
- Poiché hai 3 Sn e 3 S nel 1° membro, questi saranno anche i tuoi coefficienti nel 2° membro:
3 SnS + HCl + 4 HNO3 → 3 SnCl4 + 3 S+NO+H2oh
- Con ciò, il secondo membro è rimasto con 12 Cl (3. 4 = 12), quindi 12 sarà il coefficiente della sostanza in cui si trova Cl nel 1° membro, che è HCl:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + NO + H2oh
- Abbiamo ora 16 H nel 1° membro (12 + 4 = 16), quindi il coefficiente di H2O sarà uguale a 8, perché 8 moltiplicato per l'indice di idrogeno, che è 2, dà 16:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + NO +8h2oh
- Inoltre nel 1° membro c'è anche 4 N, quindi 4 sarà anche il coefficiente di N nel 2° membro:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + 4 NO +8 H2oh
Si noti che la quantità di ossigeno nel 1° arto (3. 4 = 12) è uguale alla quantità totale di quell'elemento nel 2° arto (4 + 8 = 12). Quindi la reazione è equilibrata.
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Aspetto:
FOGAÇA, Jennifer Rocha Vargas. "Reazioni con più di una ossidazione e/o riduzione"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/reacoes-com-mais-uma-oxidacao-ou-reducao.htm. Consultato il 27 luglio 2021.