Nel testo "Come funzionano le sostanze catalizzatrici?”, è stato dimostrato che i catalizzatori sono in grado di aumentare la velocità delle reazioni perché diminuiscono l'energia di attivazione necessaria affinché la reazione si verifichi. Lo fanno modificando il meccanismo di reazione, combinandosi con i reagenti e formando un composto intermedio, che a sua volta diventa i prodotti e il catalizzatore.
Uno dei modi perché ciò accada si chiama Catalisi omogenea, ovvero quando il catalizzatore forma un sistema monofase con i reagenti.
Ciò significa che i reagenti, i prodotti e il catalizzatore devono trovarsi tutti nella stessa fase, cioè nello stesso stato fisico.
Lo studio di questo tipo di catalisi è importante per la scienza e l'industria, poiché diverse importanti reazioni per la produzione possono essere accelerate con piccole quantità di catalizzatori.
Un esempio di catalisi omogenea utilizzata nell'industria è un passaggio intermedio nella produzione di acido solforico (H2SOLO4(ac)), in cui la formazione di anidride solforosa (SO
3(g)) attraverso la reazione di combustione dell'anidride solforosa (SO2(g)), mostrato di seguito:2 SO2(g) + O2(g) → 2 SO3(g)
Questa reazione procede troppo lentamente, quindi viene aggiunto un catalizzatore, il biossido di azoto (NO).2(g)). Questo catalizzatore si combina con l'anidride solforosa per formare un composto intermedio (complesso attivato), che è il monossido di azoto (NO(g)).
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Questo composto intermedio reagisce quindi con l'ossigeno gassoso (O2(g)) per la rigenerazione del catalizzatore. Vedi sotto come questo accade e osserva come sono tutti in fase gassosa, formando un mezzo omogeneo:
catalizzatorecomplesso attivato
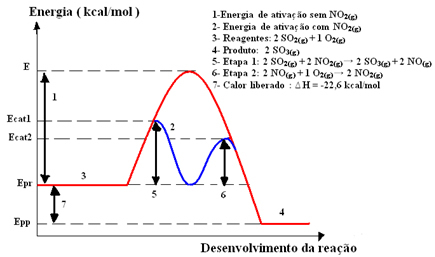
Passaggio 1: 2 SO2(g) + 2 NO2(g)→ 2 SO3(g) + 2 NO(g)
Passo 2: 2 NO(g)+ 1 O2(g) → 2 NO2 (g)
Reazione Globale: 2 SO2(g) + O2(g) → 2 SO3(g)
Si noti che il catalizzatore partecipa solo alle fasi intermedie, ma non viene consumato. Alla fine della reazione, è completamente guarito. La reazione con questo meccanismo realizzata in due fasi richiede meno energia di attivazione per verificarsi e, quindi, procede più rapidamente.
Rappresentazione grafica:
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "catalisi omogenea"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/catalise-homogenea.htm. Consultato il 27 giugno 2021.