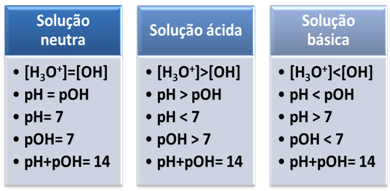
Un mezzo è considerato neutro se ha la stessa concentrazione, in mol/L, degli ioni idronio (H3oh+) e idrossido (OH-).
Un esempio di mezzo neutro che funge anche da standard per altre soluzioni è l'acqua distillata pura a una temperatura di 25ºC. A questa temperatura ha esattamente 1. 10-7 mol/L di entrambi gli ioni. Quindi, il tuo prodotto ionico (Kw) è uguale a 10-14 (mol/l)2:
Kw = [H3oh+]. [Oh-]
Kw = (1. 10-7 moli/l). (1. 10-7 mol/L) = 10-14 (mol/l)2
Il pH e il pOH sono riportati di seguito:
pH= - log [H3oh+] pOH= -log[OH-]
pH= - registro 1. 10-7 pOH= - registro 1. 10-7
pH = 7pOH = 7
Questo ci mostra che, in una soluzione neutra, il il pH è uguale a pOH.
- Mezzo acido:
In un mezzo acido, la concentrazione di ioni H3oh+ è maggiore di quello degli ioni OH-.
Tale soluzione può essere ottenuta aggiungendo una piccola parte degli ioni H3oh+, per esempio, per mezzo di un acido.
Secondo il principio di Le Chatelier, quando si provoca un disturbo ad un sistema in equilibrio, esso tende a riaggiustarsi per ridurre gli effetti di questa forza. Ciò significa che se un acido viene aggiunto all'acqua, gli ioni H
3oh+ saranno in eccesso e la bilancia si sposterà nella direzione di reazione inversa, a sinistra. Quindi questi ioni in eccesso reagiranno con gli ioni OH-. Quindi, la concentrazione di ioni OH- diminuirà e la soluzione diventerà acida.
Il prodotto ionico (Kw) è sempre uguale a 10-14, ma la concentrazione di ioni H3oh+ è maggiore della concentrazione di ioni OH-1. Pertanto, il pH è maggiore del pOH in un mezzo acido, ma la sua somma è sempre uguale a 14.
Inoltre, maggiore è la concentrazione di ioni H3oh+, maggiore è il valore del pH. A temperatura ambiente (25°C), pH < 7 e pOH > 7.

- Di base significa:
Nel mezzo basico, la concentrazione di ioni OH- è maggiore di quello degli ioni H3oh+.
Se aggiungiamo una base all'acqua, significa che stiamo aggiungendo ioni OH.- e, come spiegato nel punto precedente, dal principio di Le Chatelier, l'equilibrio della reazione di l'autoionizzazione dell'acqua si sposterà nella direzione opposta, con gli ioni in eccesso che reagiscono con ioni H3oh+, diminuendo la concentrazione e rendendo la soluzione di base.
In tal caso, il pOH sarà maggiore del pH. A temperatura ambiente (25°C), pH > 7 e pOH < 7.

Brevemente:
di Jennifer Fogaça
Laureato in Chimica

