La chimica organica è una vasta area della chimica che studia i composti del carbonio.
La conoscenza della Chimica Organica viene affrontata in diversi modi e, pensandoci, abbiamo messo insieme esercizi proposti, esami di ammissione e domande Enem per testare le tue conoscenze.
Usa anche i commenti sulle risoluzioni per saperne di più sull'argomento.
Esercizi proposti
domanda 1
Guarda i composti organici di seguito e identifica le funzioni organiche in base ai gruppi funzionali evidenziati. Successivamente, dai un nome alle sostanze.
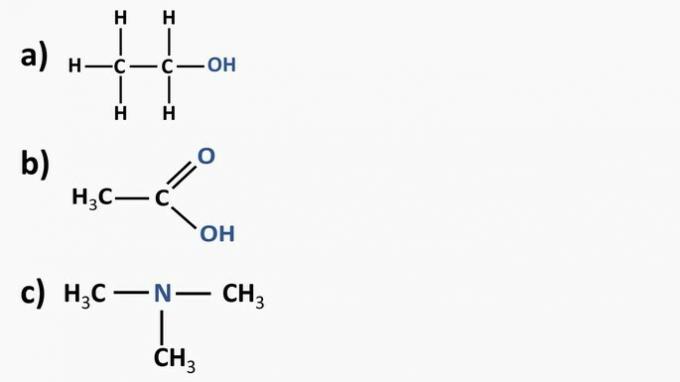
Rispondere:
a) Composto organico: etanolo
- funzione organica: alcol
- Formula generale: R—OH
- Identificazione: idrossile (OH) legato alla catena del carbonio
b) Composto organico: acido etanoico.
- Funzione organica: acido carbossilico
- Formula generale: R—COOH
- Identificazione: radicale carbossilico (COOH) legato alla catena del carbonio
c) Composto organico: trimetilammina
- Funzione organica: ammina (terziaria)
- Formula generale:
- Identificazione: azoto legato a tre catene di carbonio
Domanda 2
In chimica organica, i composti sono riconosciuti dalle catene formate da carbonio e idrogeno. Tuttavia, altri elementi possono far parte della struttura chimica di questi composti, come l'ossigeno.
Selezionare l'alternativa in cui i due composti organici hanno funzioni organiche ossigenate.
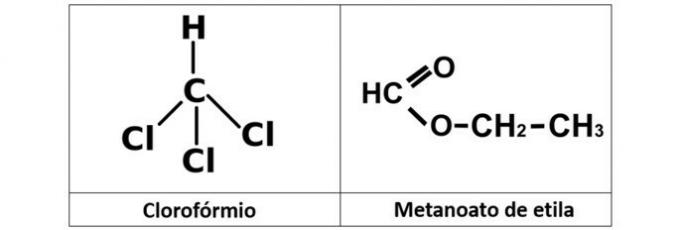
a) cloroformio ed etil metanato
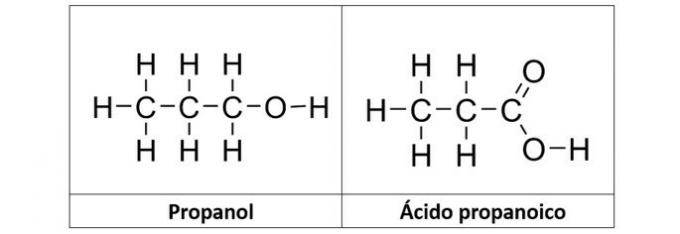
b) propanolo e acido propanoico
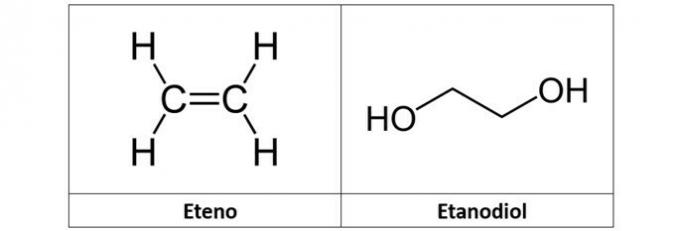
c) etene ed etandiolo
d) etanamide e benzene
Risposta corretta: b) propanolo e acido propanoico
a) SBAGLIATO. Abbiamo il cloroformio (CHCl3), che è un alogenuro alchilico, e l'estere etil metanoato (C3H6oh2), che contiene ossigeno nella sua struttura.
b) CORRETTO. In questa alternativa abbiamo due composti che hanno funzioni organiche ossigenate. Il propanolo (C3H8O) è un alcol formato da tre atomi di carbonio. L'acido propanoico (C3H6oh2) è un acido carbossilico.
c) SBAGLIATO. L'etilene (C2H4), chiamato anche etilene, è un idrocarburo di tipo alchenico. Già etandiolo (C2H6oh2) è un alcol con due ossidrili nella sua struttura.
d) SBAGLIATO. Etanamide (C2H5NO) è un'ammide e il benzene è un idrocarburo aromatico e, quindi, è formato solo da carbonio e idrogeno.

Domanda 3
Guarda la struttura del composto organico qui sotto e controlla le affermazioni vere.

(01) Il composto ha una funzione di azoto organico.
(02) È un'ammina primaria, poiché è legata a un solo idrogeno.
(03) Il nome del composto è dietilamina.
Risposta esatta:
(01) CORRETTO. La funzione organica azotata presente nel composto è l'ammina.
(02) SBAGLIATO. È un'ammina secondaria, poiché l'azoto è legato a due catene di carbonio.
(03) SBAGLIATO. Il nome del composto è dimetilammina, poiché ci sono due radicali metilici attaccati all'azoto.
domanda 4
L'eugenolo, membro della famiglia dei fenilpropanoidi, è un composto organico aromatico presente nei chiodi di garofano, spezia usata fin dall'antichità.

Osservare la formula di struttura del composto e identificare le funzioni organiche presenti.
a) Alcool ed etere
b) Fenolo ed etere
c) Alcool ed esteri
d) Fenolo ed estere
e) Alcool e idrocarburi
Alternativa corretta: b) Fenolo ed etere.
L'eugenolo ha funzioni organiche ossigenate nella sua catena, cioè, oltre agli atomi di carbonio e idrogeno, l'ossigeno è un eteroatomo presente.
La funzione organica del fenolo è caratterizzata dall'idrossile (-OH) attaccato ad un anello aromatico. Nella funzione etere, l'ossigeno si trova tra due catene di carbonio.
domanda 5
L'EDTA, il cui nome completo è acido etilendiamminotetraacetico, è un composto organico con molte applicazioni. La sua capacità di legare ioni metallici lo rende un agente chelante ampiamente utilizzato sia in laboratorio che a livello industriale.
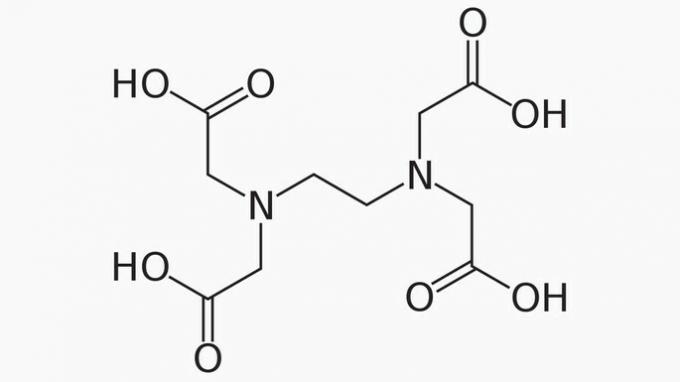
A proposito di EDTA, è corretto affermare che la catena del carbonio è:
a) Aperto, omogeneo e insaturo.
b) Chiuso, eterogeneo e saturo.
c) Aperto, eterogeneo e insaturo.
d) Chiuso, omogeneo e saturo.
e) Aperto, eterogeneo e saturo.
Risposta corretta: e) Aperto, eterogeneo e saturo.
La catena EDTA è classificata in:
APERTO. In base alla disposizione degli atomi di carbonio nella struttura dell'EDTA, si vede che, per la presenza delle estremità, la catena del composto si apre.
ETEROGENEO. Oltre ai composti di carbonio e idrogeno, la catena del carbonio ha eteroatomi di azoto e ossigeno.
SATURATO. I legami tra gli atomi di carbonio sono saturi, poiché la catena ha solo legami singoli.
Scopri di più su: Chimica organica.
domande per l'esame di ammissione
domanda 1
(UFSC) Osservare le strutture organiche incomplete e identificare gli elementi corretti:
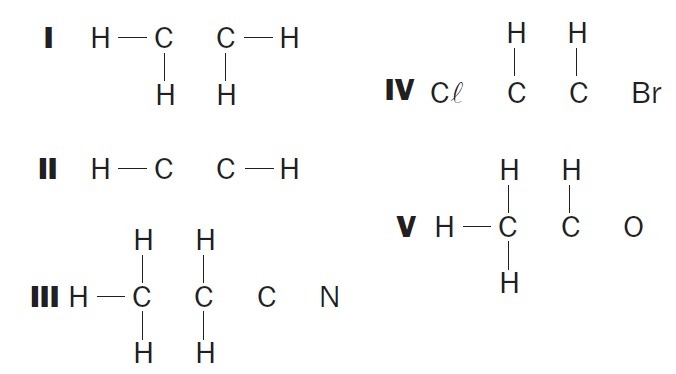
(01) La struttura I manca di un singolo legame tra gli atomi di carbonio.
(02) La struttura II manca di un triplo legame tra gli atomi di carbonio.
(03) La struttura III manca di due singoli legami tra gli atomi di carbonio e di un triplo tra gli atomi di carbonio e di azoto.
(04) Alla struttura IV mancano due singoli legami tra atomi di carbonio e alogeni e un doppio legame tra atomi di carbonio.
(05) La struttura V manca di un singolo legame tra atomi di carbonio e di un singolo legame tra atomi di carbonio e ossigeno.
Alternative corrette: 02, 03 e 04.
Oltre al carbonio, elemento chimico obbligatorio nei composti organici, altri elementi possono essere presenti nelle strutture e legati da legami covalenti, dove gli elettroni sono condivisi.
La valenza degli elementi determina il numero di legami che si possono formare, come mostrato nella tabella sottostante.
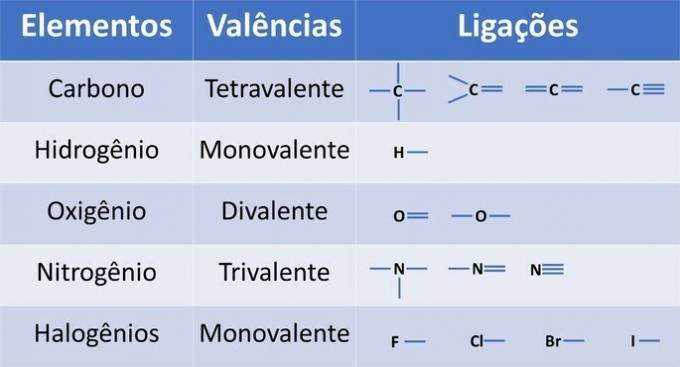
Da queste informazioni abbiamo:
(01) SBAGLIATO. La struttura manca di un doppio legame tra gli atomi di carbonio per formare il composto etenico.
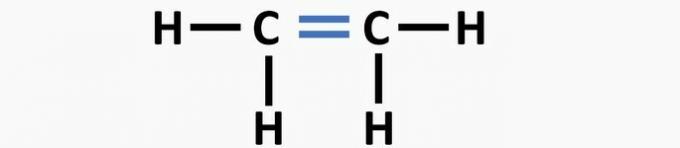
(02) CORRETTO. La struttura manca di un triplo legame tra gli atomi di carbonio per formare il composto etinico.
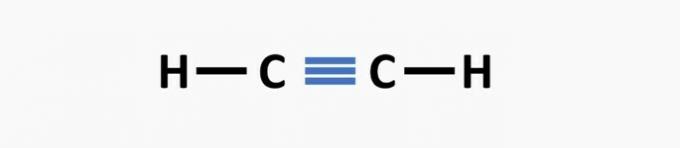
(03) CORRETTO. La struttura manca di singoli legami tra i carboni e di tripli legami tra carbonio e azoto per formare il composto propanenitrile.
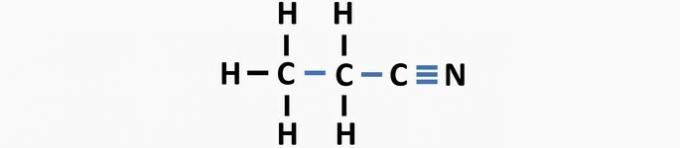
(04) CORRETTO. La struttura manca di singoli legami tra carbonio e alogeno e di doppi legami tra atomi di carbonio per formare il composto dicloroetene.
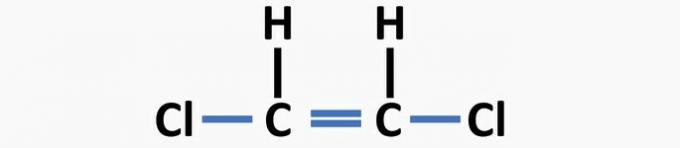
(05) SBAGLIATO. La struttura manca di un singolo legame tra i carboni e di un doppio legame tra carbonio e ossigeno per formare il composto etanico.
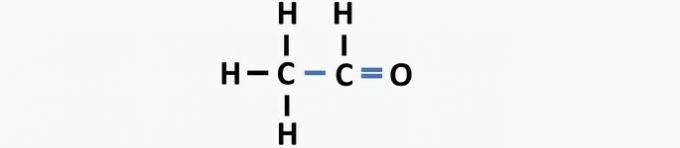
Domanda 2
(UFPB) La struttura del composto organico di formula molecolare C5H8Ciò che presenta una catena ramificata, insatura, eterogenea e aliciclica è:

Alternativa corretta: d.
Le catene di carbonio possono essere classificate come segue:
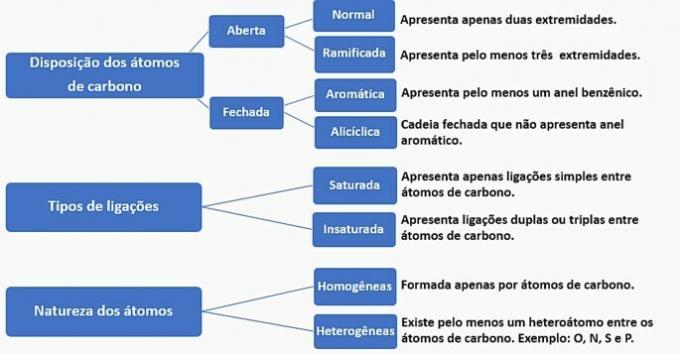
In base a queste informazioni, abbiamo:
a) SBAGLIATO. La catena è classificata come normale, satura, omogenea e aliciclica.
b) SBAGLIATO. La catena è classificata come normale, insatura, omogenea e aperta.
c) SBAGLIATO. La catena è classificata come ramificata, insatura, omogenea e aperta.
d) CORRETTO. La catena è classificata come ramificata, insatura, eterogenea e aliciclica, come
- Ha un ramo: radicale metile;
- Ha insaturazione: doppio legame tra i carboni;
- Ha un eteroatomo: ossigeno legato a due atomi di carbonio;
- Presenta una catena chiusa: carboni legati in cerchio senza la presenza di un anello aromatico.
e) SBAGLIATO. La catena è classificata come ramificata, insatura, eterogenea e aperta.
Domanda 3
(Centec-BA) Nella struttura sotto riportata, i carboni numerati sono rispettivamente:
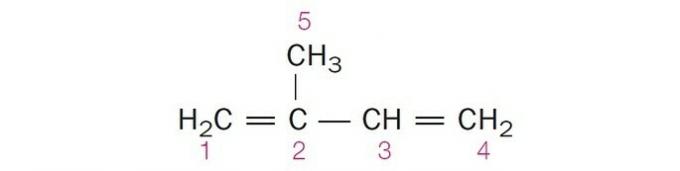
a) sp2, sp, sp2, sp2, sp3.
b) sp, sp3, sp2, sp, sp4.
c) sp2, sp2, sp2, sp2, sp3.
d) sp2, sp, sp, sp2, sp3.
e) sp3, sp, sp2, sp3, sp4.
Alternativa corretta: c) sp2, sp2, sp2, sp2, sp3.
Poiché ha 4 elettroni nel guscio di valenza, il carbonio è tetravalente, cioè ha la tendenza a formare 4 legami covalenti. Questi legami possono essere singoli, doppi o tripli.
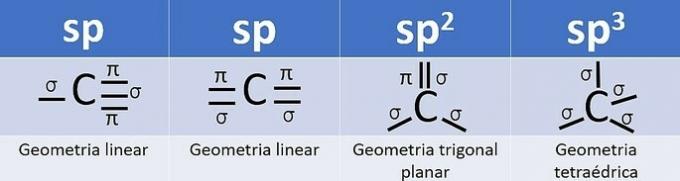
Il numero di orbitali ibridi è la somma dei legami sigma (σ) del carbonio, poiché il legame non ibrida.
- sp: 2 collegamenti sigma
- sp2: 3 collegamenti sigma
- sp3: 4 collegamenti sigma
In base a queste informazioni, abbiamo:
a) SBAGLIATO. Il carbonio 2 ha ibridazione sp2, poiché ha 3 σ legami e un legame .
b) SBAGLIATO. Il carbonio non ha ibridazione sp4 e l'ibridazione sp si verifica quando c'è un triplo legame o due doppi legami tra i carboni.
c) CORRETTO. La somma dei legami su ciascun carbonio dà l'ibridazione alternativa.
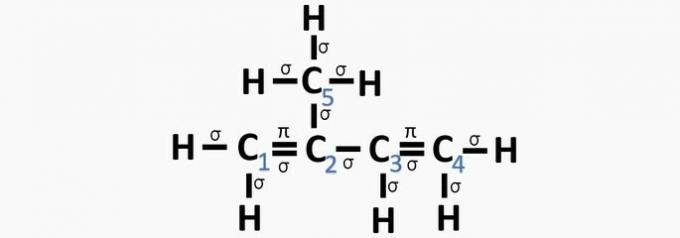
d) SBAGLIATO. L'ibridazione Sp si verifica quando c'è un triplo legame o due doppi legami tra i carboni.
e) SBAGLIATO. Il carbonio non ha ibridazione sp4 e l'ibridazione sp si verifica quando c'è un triplo legame o due doppi legami tra i carboni.
domanda 4
(UFF) Esiste un campione gassoso formato da uno dei seguenti composti: CH4; Ç2H4; Ç2H6; Ç3H6 o C3H8. Se 22 g di questo campione occupano un volume di 24,6 L ad una pressione di 0,5 atm e una temperatura di 27 °C (Dato: R = 0,082 L .atm. K–1.mol–1), si conclude che è il gas:
a) etano.
b) metano.
c) propano.
d) propilene.
e) etene.
Alternativa corretta: c) propano.
1° passo: convertire l'unità di temperatura da Celsius a Kelvin.
2° passaggio: calcolare il numero di moli del composto utilizzando l'equazione generale dei gas.
3° passo: calcolare la massa molare del composto.
4° passo: trova l'idrocarburo che ha una massa molare di 44 g/mol.
Metano
etene
Etano
propilene
Propano
Pertanto, si conclude che il gas che corrisponde alle informazioni nella dichiarazione è propano.
domanda 5
(ITA) Considerare le seguenti sostanze:
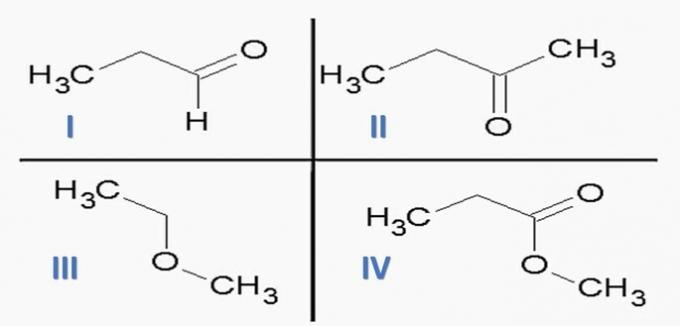
e le seguenti funzioni chimiche:
Il. acido carbossilico;
B. alcool;
ç. aldeide;
d. chetone;
e. estere;
f. etere.
L'opzione che associa CORRETTAMENTE le sostanze con funzioni chimiche è:
a) ID; IIc; IIIe; IVf.
b) Ci; IId; IIIe; I.V.A.
c) Ic; IId; IIIf; Io ho.
d) ID; IIc; IIIf; Io ho.
e) Ia; IIc; IIIe; IVd.
Alternativa corretta: c) Ic; IId; IIIf; Io ho.
Le funzioni organiche sono determinate da strutture e raggruppano composti organici con caratteristiche simili.
Le funzioni chimiche presenti nelle alternative sono:
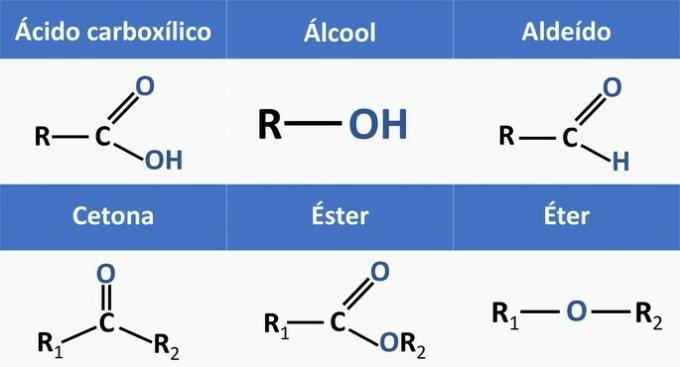
Analizzando le suddette strutture e i composti presenti nell'enunciato, abbiamo:
a) SBAGLIATO. Le funzioni dell'organo sono corrette, ma la sequenza è sbagliata.
b) SBAGLIATO. Non c'è acido carbossilico tra i composti.
c) CORRETTO. I gruppi funzionali presenti nei composti rappresentano le seguenti funzioni chimiche.

d) SBAGLIATO. I è aldeide e II è chetone.
e) SBAGLIATO. Non c'è acido carbossilico tra i composti.
Scopri di più su: Funzioni organiche.
Domande sui nemici
domanda 1
(Enem/2014) Un metodo per determinare il contenuto di etanolo nella benzina consiste nel mescolare volumi noti di acqua e benzina in una bottiglia specifica. Dopo aver agitato il pallone e atteso un certo periodo di tempo, si misurano i volumi delle due fasi immiscibili che si ottengono: una organica e l'altra acquosa. L'etanolo, una volta miscibile con la benzina, ora è miscibile con l'acqua.
Per spiegare il comportamento dell'etanolo prima e dopo l'aggiunta di acqua, è necessario sapere
a) la densità dei liquidi.
b) la dimensione delle molecole.
c) il punto di ebollizione dei liquidi.
d) gli atomi presenti nelle molecole.
e) il tipo di interazione tra le molecole.
Alternativa corretta: e) il tipo di interazione tra le molecole.
Le forze intermolecolari influenzano la solubilità dei composti organici. Le sostanze tendono a dissolversi tra loro quando hanno la stessa forza intermolecolare.
Vedere nella tabella sottostante alcuni esempi di funzioni organiche e il tipo di interazione tra le molecole.
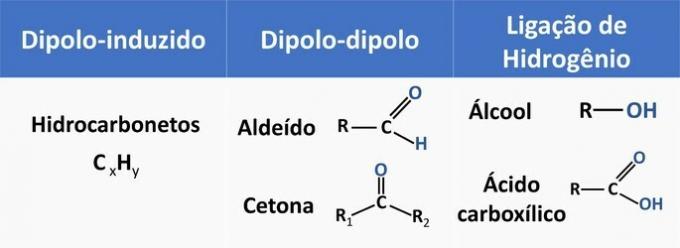
L'etanolo è considerato un solvente polare, poiché ha un gruppo polare (-OH) nella sua struttura. Tuttavia, la sua catena di carbonio, essendo non polare (CH), è in grado di interagire con solventi non polari. Pertanto, l'etanolo si solubilizza sia in acqua che in benzina.
In base a queste informazioni, abbiamo:
a) SBAGLIATO. La densità mette in relazione la massa di un corpo con il volume occupato.
b) SBAGLIATO. La dimensione delle molecole influenza la polarità dei composti: più grande è la catena di carbonio, più apolare diventa la sostanza.
c) SBAGLIATO. Il punto di ebollizione è utile per separare le molecole: la distillazione separa i composti con diversi punti di ebollizione. Più basso è il punto di ebollizione, più facilmente la molecola viene vaporizzata.
d) SBAGLIATO. Un'aldeide ha carbonio, idrogeno e ossigeno nella sua struttura. Questo composto svolge interazioni dipolo-dipolo, mentre un alcol, avente gli stessi elementi, è in grado di formare legami idrogeno.
e) CORRETTO. L'interazione dell'etanolo con l'acqua (legame idrogeno) è più intensa che con la benzina (diplo-indotta).
Domanda 2
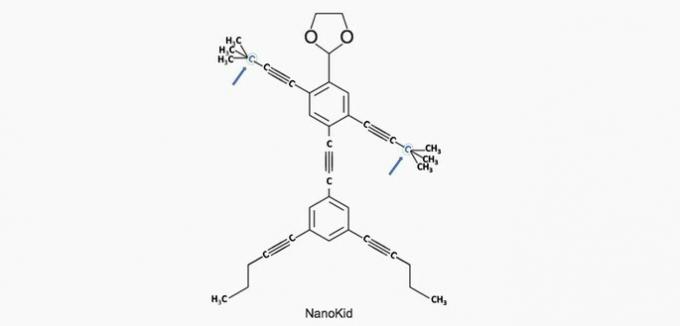
(Enem/2013) Le molecole di nanopuziani somigliano a figure umane e nascono per stimolare l'interesse dei giovani alla comprensione del linguaggio espresso in formule di struttura, largamente utilizzate in chimica organica. Un esempio è NanoKid, rappresentato in figura:
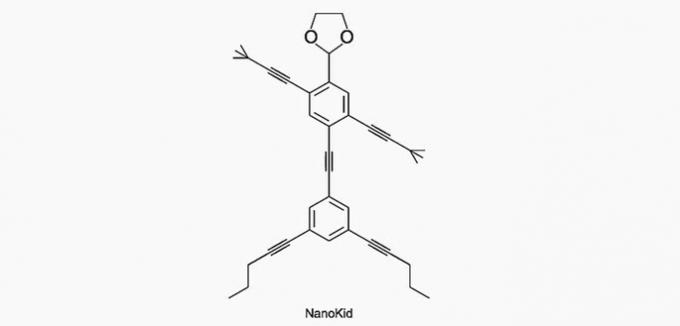
Dove c'è carbonio quaternario nel corpo del NanoKid?
a) Mani.
b) Capo.
c) Petto.
d) Addome.
e) Piedi.
Alternativa corretta: a) Mani.
Il carbonio è classificato come segue:
- Primario: si lega a un carbonio;
- Secondario: si lega a due atomi di carbonio;
- Terziario: si lega a tre atomi di carbonio;
- Quaternario: si lega a quattro atomi di carbonio.
Vedere gli esempi di seguito.

In base a queste informazioni, abbiamo:
a) CORRETTO. Il carbonio nella mano è legato ad altri quattro atomi di carbonio, quindi è quaternario.
b) SBAGLIATO. La testa è costituita da carboni primari.
c) SBAGLIATO. Il torace è costituito da carboni secondari e terziari.
d) SBAGLIATO. L'addome è costituito da atomi di carbonio secondari.
e) SBAGLIATO. I piedi sono realizzati con carboni primari.
Domanda 3
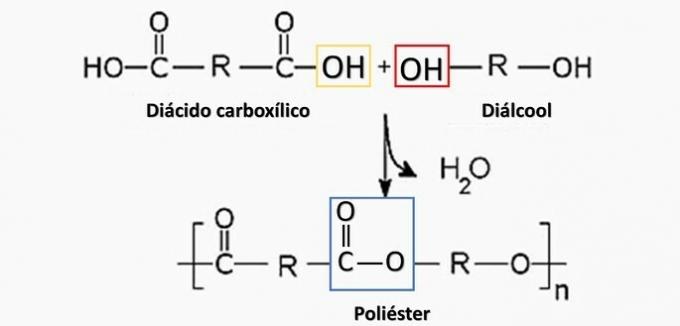
(Enem/2014) Alcuni materiali polimerici non possono essere utilizzati per la produzione di determinati tipi di manufatti, sia per limitazioni delle proprietà meccaniche, sia per la facilità con cui subiscono il degrado, generando sottoprodotti indesiderati per questo applicazione. Pertanto, l'ispezione diventa importante per determinare la natura del polimero utilizzato nella fabbricazione del manufatto. Uno dei metodi possibili si basa sulla decomposizione del polimero per generare i monomeri che lo hanno originato.
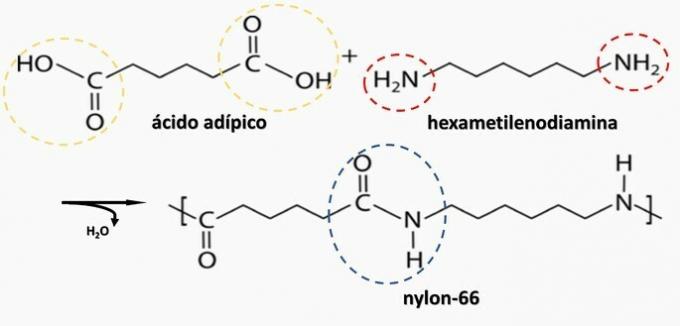
Decomposizione controllata di un artefatto generato diammina H2N(CH2)6NH2 e l'HO diacid2C(CH2)4CO2h. Pertanto, il manufatto è stato fatto di
a) poliestere.
b) poliammide.
c) polietilene.
d) poliacrilato.
e) polipropilene.
Alternativa corretta: b) poliammide.
a) SBAGLIATO. Il poliestere si forma nella reazione tra un acido dicarbossilico (—COOH) e un dialcool (—OH).
b) CORRETTO. La poliammide è formata dalla polimerizzazione di un acido dicarbossilico (—COOH) con una diammina (—NH2).
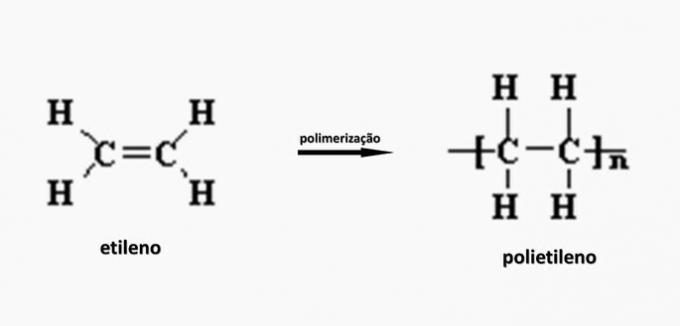
c) SBAGLIATO. Il polietilene si forma nella polimerizzazione del monomero di etilene.
d) SBAGLIATO. Il poliacrilato è formato da un sale derivato dall'acido carbossilico.
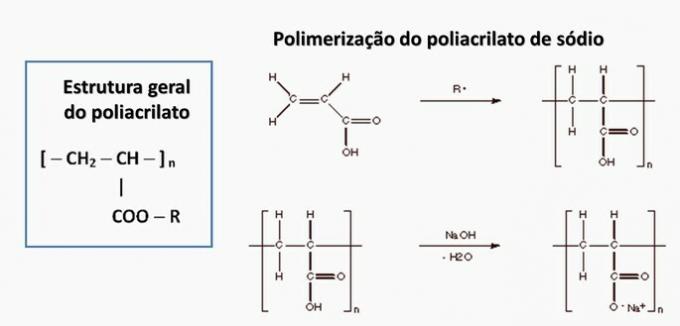
e) SBAGLIATO. Il polipropilene si forma nella polimerizzazione del monomero di propilene.
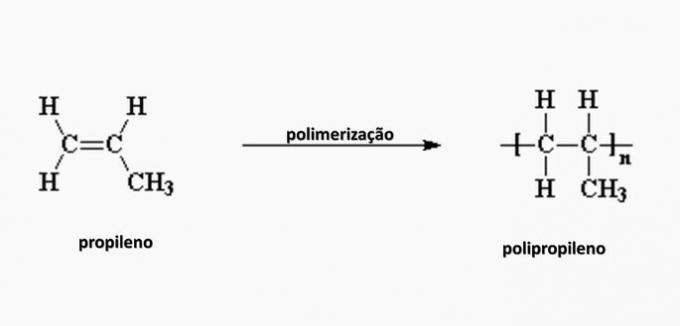
domanda 4
(Enem/2008) La Cina si è impegnata a risarcire la Russia per la fuoriuscita di benzene da un'industria Petrolchimica cinese nel fiume Songhua, un affluente del fiume Amur, che fa parte del confine tra i due paesi. Il presidente dell'Agenzia federale per le risorse idriche della Russia ha assicurato che il benzene non raggiungerà le condutture di potabile, ma ha chiesto alla popolazione di far bollire l'acqua corrente ed evitare di pescare nel fiume Amur e nei suoi affluenti. Le autorità locali stanno immagazzinando centinaia di tonnellate di carbone, poiché il minerale è considerato un efficace assorbitore di benzene. Internet: (con adattamenti). Tenuto conto delle misure adottate per ridurre al minimo i danni all'ambiente e alla popolazione, è corretto affermare che
a) il carbone, posto in acqua, reagisce con il benzene, eliminandolo.
b) il benzene è più volatile dell'acqua e quindi necessita di essere bollito.
c) l'orientamento ad evitare la pesca è dovuto alla necessità di preservare il pesce.
d) il benzene non contaminerebbe le condutture dell'acqua potabile, in quanto verrebbe naturalmente decantato sul fondo del fiume.
e) l'inquinamento causato dalla fuoriuscita di benzene dell'industria cinese sarebbe limitato al fiume Songhua.
Alternativa corretta: b) il benzene è più volatile dell'acqua e quindi è necessario che venga bollito.
a) SBAGLIATO. Il carbone contiene nella sua struttura diversi pori e viene utilizzato come adsorbente, in quanto è in grado di interagire con i contaminanti e di trattenerli sulla sua superficie, ma non di eliminarli.
b) CORRETTO. Maggiore è la volatilità di una sostanza, più facilmente si trasforma in uno stato gassoso. Mentre il punto di ebollizione dell'acqua è 100°C, quello del benzene è 80,1°C. Questo perché l'acqua è un composto polare e il benzene è un composto non polare.
Il tipo di interazioni che le molecole fanno sono diverse e influenzano anche il punto di ebollizione delle sostanze. La molecola d'acqua è in grado di formare legami idrogeno, un tipo di interazione molto più forte di quella che il benzene, con il dipolo indotto, è in grado di fare.
c) SBAGLIATO. In una catena alimentare, un essere diventa il cibo di un altro in base alle interazioni delle specie in un luogo. Quando una sostanza tossica viene rilasciata in un ambiente, si ha un progressivo accumulo e pesci contaminati, se ingeriti dall'uomo, possono portare con sé benzene e causare mutazioni del DNA e persino persino il cancro.
d) SBAGLIATO. Il benzene ha una densità inferiore a quella dell'acqua. Quindi, la tendenza è che anche sott'acqua continui a diffondersi.
e) SBAGLIATO. I cambiamenti stagionali possono aumentare ulteriormente il problema, poiché le basse temperature riducono la capacità di decomposizione biologica delle sostanze chimiche per azione del sole o dei batteri.
domanda 5
(Enem/2019) Gli idrocarburi sono molecole organiche con una serie di applicazioni industriali. Ad esempio, sono presenti in grandi quantità in varie frazioni petrolifere e vengono solitamente separate mediante distillazione frazionata in base alla loro temperatura di ebollizione. La tabella presenta le principali frazioni ottenute nella distillazione del petrolio a diversi intervalli di temperatura.
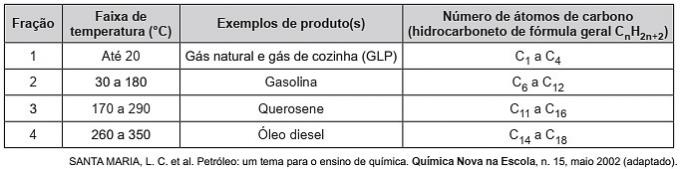
Nella frazione 4, la separazione dei composti avviene a temperature più elevate perché
a) le loro densità sono maggiori.
b) il numero delle filiali è maggiore.
c) la sua solubilità in olio è maggiore.
d) le forze intermolecolari sono più intense.
e) la catena di carbonio è più difficile da spezzare.
Alternativa corretta: d) le forze intermolecolari sono più intense.
Gli idrocarburi interagiscono per dipolo indotto e questo tipo di forza intermolecolare si intensifica con l'aumento della catena di carbonio.
Pertanto, le frazioni petrolifere più pesanti hanno una temperatura di ebollizione più elevata, poiché le catene interagiscono più fortemente per un dipolo indotto.
Per ulteriori esercizi, con risoluzione commentata, vedere anche:
- Esercizi sugli Idrocarburi
- Esercizi sulle funzioni organiche
- Domande di chimica in Enem


