L'osmosi è il movimento dell'acqua che avviene all'interno delle cellule attraverso una membrana semipermeabile.
In questo processo, le molecole d'acqua si spostano da un mezzo meno concentrato a un mezzo più concentrato.
Pertanto, l'osmosi serve a bilanciare i due lati della membrana, provocando la diluizione del mezzo ricco di soluti dal solvente, che è l'acqua.
Come si verifica l'osmosi?
L'osmosi è considerata un trasporto passivo, come nel passaggio attraverso la membrana nessuna energia viene sprecata.
Nel processo di osmosi l'acqua, che è il solvente, tende ad attraversare la membrana semipermeabile per bilanciare la concentrazione della soluzione. Questa azione viene eseguita fino a quando la pressione osmotica non si stabilizza.
Pertanto, l'acqua si sposta dalla regione meno concentrata a quella più concentrata, naturalmente.
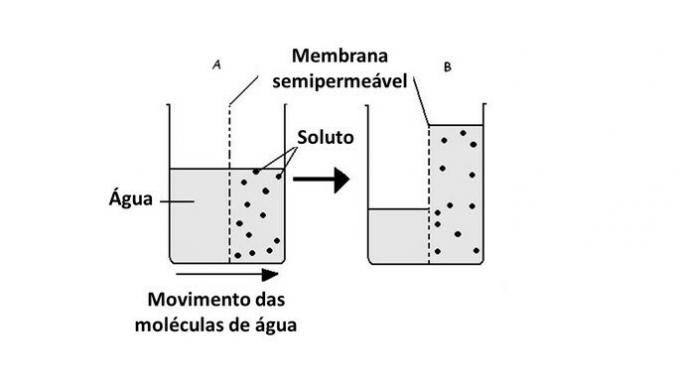
Il passaggio dell'acqua da un mezzo all'altro avviene nelle cellule con l'aiuto del trasporto di proteine nella membrana, le acquaporine. Pertanto, l'osmosi si verifica ogni volta che c'è una differenza di concentrazione tra l'ambiente esterno e quello interno della cellula.
Il risultato dell'osmosi viene utilizzato nei processi di scambio dei nutrienti delle cellule animali e vegetali.
Leggi anche su Trasporto passivo e Trasporto attivo.
Soluzione ipotonica, isotonica e ipertonica
Come abbiamo visto, il processo di osmosi mira ad equalizzare le concentrazioni delle soluzioni, fino al raggiungimento di un equilibrio. Per questo abbiamo i seguenti tipi di soluzione:
- soluzione ipertonica: presenta una maggiore pressione osmotica e concentrazione di soluti.
- soluzione ipotonica: presenta una pressione osmotica e una concentrazione di soluti inferiori.
- soluzione isotonica: la concentrazione di soluto e la pressione osmotica sono uguali, raggiungendo così l'equilibrio.
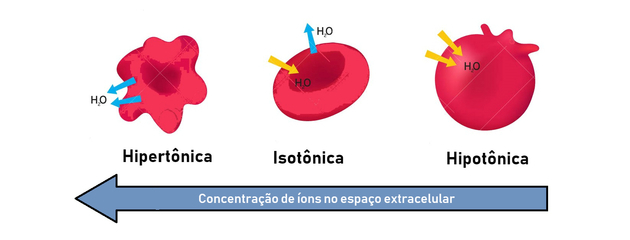
Pertanto, l'osmosi si verifica tra un modo ipertonico (più concentrato) e ipotonico (meno concentrato) per generare un equilibrio.
esempi di osmosi
Nelle cellule, la membrana plasmatica è un involucro formato da un doppio strato lipidico, che ostacola il movimento dell'acqua nella cellula. Esistono però proteine specializzate nella sua struttura, le acquaporine, che fungono da canali che facilitano il passaggio delle molecole d'acqua.
In un ambiente ipertonico, le cellule tendono a ridursi man mano che perdono acqua. Una cellula posta in un mezzo ipotonico può gonfiarsi fino a rompersi, poiché c'è movimento di acqua nella cellula.
Vedi sotto come si verifica l'osmosi nelle cellule animali e vegetali.
Osmosi in cellula animale
Quando un cellula animale, come i globuli rossi, sono esposti a mezzi con diverse concentrazioni, il movimento dell'acqua nella cellula avviene come segue:
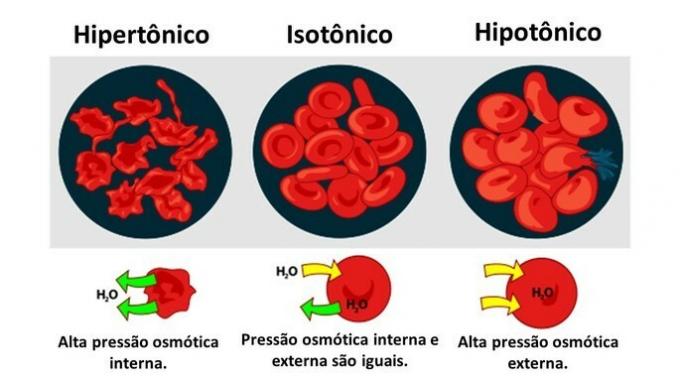
Quando il terreno è ricco di soluto, soluzione ipertonica rispetto al citoplasma, le cellule perdono acqua nel terreno e avvizziscono.
Quando il mezzo è povero di soluto, una soluzione ipotonica, le molecole d'acqua tendono ad entrare nella cellula e, sebbene la membrana sia resistente, a seconda della quantità, può verificarsi la rottura.
Osmosi cellulare vegetale Plant
Il movimento dell'acqua nelle cellule vegetali avviene tra il vacuolo cellulare e l'ambiente extracellulare.
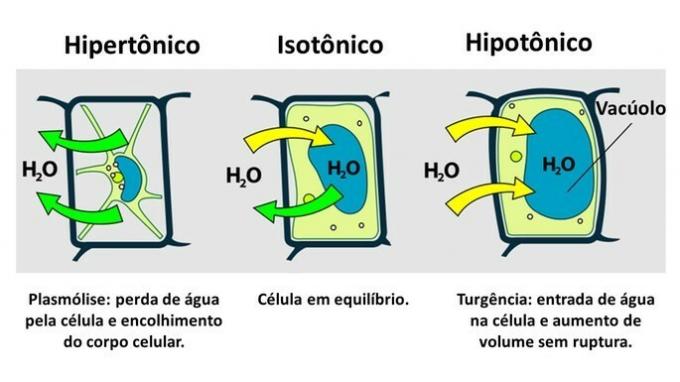
IL cellula vegetale possiede, oltre alla membrana plasmatica, una parete cellulare molto resistente, che è formata da cellulosa.
Pertanto, a differenza della cellula animale, la cellula vegetale resiste alla rottura quando è inserita in un ambiente ipotonico, dove l'acqua tende ad entrare nella cellula. La cellula si gonfia, aumentando il suo volume, ma la parete cellulare impedisce la rottura.
La perdita di acqua da parte di una cellula vegetale, che è inserita in un ambiente ipertonico, è chiamata plasmolisi. L'ingresso di acqua nel vacuolo quando la cellula si trova in un mezzo ipotonico si chiama turgenza, quando si verifica un aumento del volume cellulare.
In che modo la pressione osmotica influenza l'osmosi?
Un soluto è qualsiasi sostanza che può essere diluita in un solvente, come lo zucchero sciolto in acqua. Mentre la pressione osmotica è la pressione esercitata dall'acqua per muoversi.
Poiché l'osmosi è un processo che avviene dal mezzo meno concentrato (ipotonico) al più concentrato (ipertonico) in ricerca dell'equilibrio, la pressione osmotica è la pressione esercitata su un sistema per evitare che si verifichi l'osmosi naturalmente.
Pertanto, maggiore è la differenza di concentrazione tra il mezzo ipertonico e ipotonico, maggiore dovrebbe essere la pressione osmotica applicata sulla soluzione più concentrata per evitare l'osmosi.
Impara di più riguardo pressione osmotica.
Cos'è l'osmosi inversa e come funziona
L'osmosi inversa è il passaggio dell'acqua nella direzione opposta all'osmosi. Pertanto, l'acqua si sposta da una soluzione più concentrata a una meno concentrata.
L'osmosi inversa avviene applicando una pressione maggiore della pressione osmotica naturale.
Poiché la membrana semipermeabile consente solo il passaggio del solvente (acqua pura), trattiene i soluti.
Un esempio di osmosi inversa è la trasformazione dell'acqua salata in acqua dolce mediante il processo di desalinizzazione.
Impara di più riguardo osmosi inversa.
Differenza tra osmosi e diffusione
La diffusione è il passaggio di molecole molto piccole di gas e soluti disciolti in acqua attraverso il membrana plasmatica. In questo caso, le molecole di soluto si sposteranno dal mezzo più concentrato al mezzo meno concentrato. Si muovono lungo un gradiente di concentrazione e si estendono nello spazio disponibile.
IL diffusione facilitata è il passaggio, attraverso la membrana, di sostanze che non si dissolvono nei lipidi, con l'ausilio di proteine che permeano il doppio strato lipidico.
Come l'osmosi, anche la diffusione è considerata a trasporto passivo, in quanto avviene a favore di un gradiente di concentrazione.
Curiosità
L'espressione "imparare per osmosi" è ampiamente utilizzata dagli studenti che desiderano apprendere nuovi contenuti senza dover studiare, cioè senza fare uno sforzo.
Leggi anche:
- Soluto e solvente
- Pompa per sodio e potassio
- Permeabilità selettiva

