La concentrazione comune è la quantità di soluto, in grammi, in 1 litro di soluzione.
Matematicamente, la concentrazione comune è espressa da:
1. (Mackenzie) Qual è la concentrazione, in g/L, della soluzione ottenuta sciogliendo 4 g di cloruro di sodio in 50 cm3 d'acqua?
a) 200 g/l
b) 20 g/l
c) 0,08 g/L
d) 12,5 g/L
e) 80 g/l
Alternativa corretta: e) 80 g/L.
1° passo: trasformare l'unità di volume di cm3 a l.
Sapendo che 1 cm3 = 1 ml, allora abbiamo:
Passaggio 2: applicare i dati nella formula di concentrazione comune:
2. (Mackenzie) Ci sono cinque contenitori contenenti soluzioni acquose di cloruro di sodio.
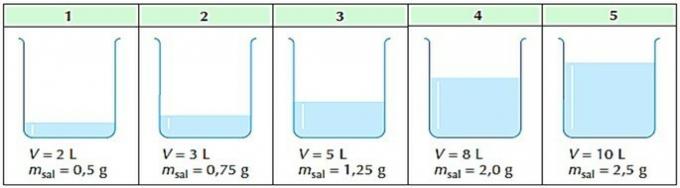
È corretto dire che:
a) il contenitore 5 contiene la soluzione meno concentrata.
b) il contenitore 1 contiene la soluzione più concentrata.
c) solo i contenitori 3 e 4 contengono soluzioni di uguale concentrazione.
d) le cinque soluzioni hanno la stessa concentrazione.
e) il contenitore 5 contiene la soluzione più concentrata.
Alternativa corretta: d) le cinque soluzioni hanno la stessa concentrazione.
Applicazione della formula di concentrazione comune per ciascuno dei contenitori abbiamo:
| 1 | 2 | 3 | 4 | 5 |
|---|---|---|---|---|
Dai calcoli eseguiti, vediamo che tutte le soluzioni hanno la stessa concentrazione.
3. (UFPI) La nuova normativa sulla circolazione prevede un limite massimo di 6 decigrammi di alcol, C2H5OH, per litro di sangue dal conducente (0,6 g/L). Considerando che la percentuale media di alcol ingerito che rimane nel sangue è del 15% in massa, individuare, per un adulto con un peso medio di 70 kg il cui volume di sangue è di 5 litri, il numero massimo di lattine di birra (volume = 350 ml) ingerite senza che il limite stabilito sia obsoleto. Informazioni aggiuntive: la birra ha il 5% di alcol in volume e la densità alcolica è di 0,80 g/mL.
a 1
b) 2
c) 3
d) 4
e) 5
Alternativa corretta: a) 1.
Dati della domanda:
- Limite massimo consentito di alcol nel sangue: 0,6 g/L
- Percentuale di alcol ingerito rimasto nel sangue: 15%
- Volume di sangue: 5 L
- Volume della lattina di birra: 350 ml
- Grado alcolico nella birra: 5%
- Densità alcolica: 0,80 g/mL
1° passo: Calcolare la massa di alcol in 5 L di sangue.
2a fase: calcolare la massa alcolica totale, poiché solo il 15% è stato assorbito nel flusso sanguigno.
3° passo: Calcolare il volume di alcol presente nella birra.
4° passo: Calcola il volume massimo di birra che può essere consumato.
5° passo: Interpretazione dei risultati.
Il volume massimo di birra che una persona può bere in modo che la concentrazione di alcol nel sangue non superi 0,6 g/L è di 500 ml.
Ogni birra contiene 350 ml e quando si consumano due lattine, il volume è di 700 ml, che supera il volume stabilito. In quanto tale, il massimo che una persona può ingerire è una lattina.
4. (UNEB) Il siero fatto in casa è costituito da una soluzione acquosa di cloruro di sodio (3,5 g/L) e saccarosio (11 g/L). Le masse di cloruro di sodio e saccarosio necessarie per preparare 500 ml di siero casalingo sono rispettivamente:
a) 17,5 g e 55 g
b) 175 g e 550 g
c) 1750 mg e 5500 mg
d) 17,5 mg e 55 mg
e) 175 mg e 550 mg
Alternativa corretta: c) 1750 mg e 5500 mg.
Calcola la massa del cloruro di sodio
1° passaggio: trasformare l'unità di volume da ml a L.
2° passo: calcola la massa in grammi.
3° passaggio: Trasforma il valore trovato in milligrammi.
Calcola la massa di saccarosio
1° passo: Calcola la massa in grammi.
Sapendo che 500 mL = 0,5 L, allora abbiamo:
2° passaggio: trasformare il valore trovato in milligrammi.
a) 8.0
b) 6.0
c) 4.0
d) 2.0
e) 1.0
Alternativa corretta: d) 2.0.
1° passaggio: trasformare l'unità di volume da ml a L.
2° passo: Calcolare la massa del cloruro di magnesio (MgCl2).
a) 6.0. 101 kg
b) 6.0. 104 kg
c) 1.8. 102 kg
d) 2.4. 108 kg
e) 8.0. 106 kg
Alternativa corretta: a) 6.0. 101 kg.
1° passo: Calcolare la massa dei sali disciolti nell'acquario.
Sapendo che 1 L = 1000 mL = 1000 cm3, noi abbiamo:
Passaggio 2: trasforma l'unità di massa da grammi a chili.
3° passaggio: Trasforma il risultato in notazione scientifica.
Come numero in notazione scientifica ha il formato N. 10no, per trasformare 60 kg in notazione scientifica "camminiamo" con la virgola e la posizioniamo tra 6 e 0.
Abbiamo N = 6.0 e poiché stiamo camminando solo di una cifra decimale, il valore di n è 1 e la risposta corretta è: 6.0. 101 kg.
Risposta corretta: 40 gocce.
Dati della domanda:
- Dose analgesica raccomandata: 3 mg/kg
- Quantità di analgesico in goccia: 5 mg di analgesico
- peso del paziente: 70 kg
1° passo: Calcolare la quantità di analgesico in base al peso del paziente.
La quantità calcolata supera la dose massima. Pertanto, devono essere somministrati 200 mg, che corrisponde al limite consentito.
2° passo: Calcolare la quantità di caduta analgesica.
8. (Enem) Una data stazione tratta circa 30 000 litri di acqua al secondo. Per evitare il rischio di fluorosi, la concentrazione massima di fluoruri in quest'acqua non deve superare circa 1,5 milligrammi per litro d'acqua. La quantità massima di questa specie chimica che può essere tranquillamente utilizzata, nel volume di acqua trattata in un'ora, in questa stazione, è:
a) 1,5 kg
b) 4,5 kg
c) 96 kg
d) 124 kg
e) 162 kg
Alternativa corretta: e) 162 kg.
Dati della domanda:
- Acqua trattata: 30.000 L/s
- Concentrazione di fluoro: 1,5 mg/L
1° passo: trasforma le ore in minuti.
2a fase: calcolare la massa di fluoruro in 30000 L/s.
3° passo: Calcolare la massa per il tempo di 1 h (3600 s).
Passaggio 4: trasformare l'unità di massa da mg a kg.
9. (UFRN) Uno dei potenziali economici del Rio Grande do Norte è la produzione di sale marino. Il cloruro di sodio si ottiene dall'acqua di mare nelle saline costruite vicino alla costa. In generale, l'acqua di mare attraversa più vasche di cristallizzazione fino ad una determinata concentrazione. Supponiamo che, in una delle fasi del processo, un tecnico abbia prelevato 3 campioni da 500 ml da a cristallizzazione, evaporato con ogni campione e annotato la massa di sale risultante nella tabella a Seguire:
| Campione | Volume del campione (ml) | Massa di sale (g) |
|---|---|---|
| 1 | 500 | 22 |
| 2 | 500 | 20 |
| 3 | 500 | 24 |
La concentrazione media dei campioni sarà:
a) 48 g/l
b) 44 g/l
c) 42 g/l
d) 40 g/l
Alternativa corretta: b) 44 g/L.
1° passaggio: trasformare l'unità di volume da ml a L.
Passaggio 2: applicare la formula di concentrazione comune per ciascuno dei campioni.
| 1 | 2 | 3 |
|---|---|---|
3° passaggio: Calcolare la concentrazione media.
10. (Favest) Consideriamo due lattine della stessa soda, una nella versione “dieta” e l'altra nella versione comune. Entrambi contengono lo stesso volume di liquido (300 ml) e hanno la stessa massa quando sono vuoti. La composizione del refrigerante è la stessa in entrambi, tranne per una differenza: la versione comune contiene un certo quantità di zucchero, mentre la versione “dieta” non contiene zucchero (solo massa trascurabile di un dolcificante artificiale). Pesando due lattine di soda chiuse, si ottengono i seguenti risultati:
| Campione | Massa (g) |
|---|---|
| Può con soda normale | 331,2 g |
| Lattina con soda "dieta" | 316,2 g |
Sulla base di questi dati, si può concludere che la concentrazione, in g/L, di zucchero nelle normali bevande analcoliche è approssimativamente:
a) 0,020
b) 0,050
c) 1.1
d) 20
e) 50
Alternativa corretta: e) 50.
1° passo: Calcolare la massa di zucchero.
Poiché l'unica differenza tra le bibite è la massa di zucchero, presente solo nella versione comune, possiamo trovarla sottraendo le masse date da ciascun campione.
2° passaggio: trasformare l'unità di volume da ml a L.
3° passo: Calcolare la concentrazione di zucchero.
Per ulteriori informazioni sulle soluzioni chimiche, vedere anche questi testi.:
- Soluto e solvente
- Diluizione delle soluzioni
- molarità
- molalità
