oh bilanciamento dell'equazione ci permette di abbinare il numero di atomi presenti nell'equazione chimica in modo che diventi vero e rappresenti una reazione chimica.
Usa le domande qui sotto per testare le tue conoscenze e controlla le risposte commentate dopo il feedback per rispondere alle tue domande.
domanda 1
(Mackenzie-SP)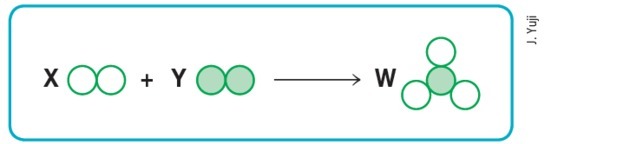
Supponendo che i cerchi vuoti e pieni significhino rispettivamente atomi diversi, allora lo schema sopra rappresenterà una reazione chimica bilanciata se sostituiamo le lettere X, Y e W, rispettivamente, con il valori:
a) 1, 2 e 3.
b) 1, 2 e 2.
c) 2, 1 e 3.
d) 3, 1 e 2.
e) 3, 2 e 2.
Alternativa d) 3, 1 e 2.
1° passo: Assegniamo lettere per rendere l'equazione più facile da capire.
2° passo: sommiamo gli indici per scoprire chi ha più atomi nell'equazione.
| IL | |
| B |
A e B compaiono solo una volta in ogni membro dell'equazione. Tuttavia, se sommiamo gli indici vediamo che A ha il valore più alto. Pertanto, abbiamo iniziato il bilanciamento per lui.
3° passo: Bilanciamo l'elemento A trasponendo gli indici e trasformandoli in coefficienti.
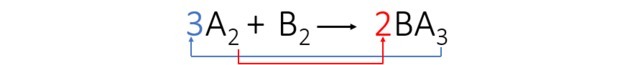
Abbiamo osservato che l'elemento B è stato automaticamente bilanciato e i coefficienti dell'equazione sono: 3, 1 e 2.
Domanda 2
(Unicamp-SP) Leggi la seguente frase e trasformala in un'equazione chimica (bilanciata), usando simboli e formule: “una molecola di azoto gassoso, contenente due atomi di azoto per molecola, reagisce con tre molecole di idrogeno biatomico, gassoso, producendo due molecole di ammoniaca gassosa, che è composta da tre atomi di idrogeno e uno di azoto".
Rispondere:
Rappresentando gli atomi descritti nella domanda, possiamo capire che la reazione avviene come segue:
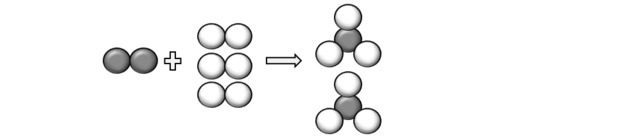
Quindi arriviamo all'equazione:
Domanda 3
Il perossido di idrogeno è un composto chimico che può decomporsi, formando acqua e ossigeno, secondo l'equazione chimica sottostante.
Per quanto riguarda questa reazione, l'equazione correttamente bilanciata è:
a) H2oh2 → Il2 + H2oh
b) 2h2oh2 → Il2 + 2H2oh
c) H2oh2 → 2O2 + H2oh
d) 2H2oh2 → 2O2 + 2H2oh
Alternativa corretta: b) 2H2oh2 → Il2 + 2H2oh
Nota che il perossido di idrogeno è una sostanza chimica composta da atomi di due elementi chimici: idrogeno e ossigeno.
Dopo la reazione di decomposizione si deve avere lo stesso numero di atomi dei due elementi sia nei reagenti che nei prodotti. Per questo, dobbiamo bilanciare l'equazione.
Nota che abbiamo 2 atomi di idrogeno nel reagente (H2oh2) e due atomi nel prodotto (H2O). Tuttavia, l'ossigeno ha due atomi nel reagente (H2oh2) e tre atomi nei prodotti (H2O e O2).
Se anteponiamo il coefficiente 2 al perossido di idrogeno raddoppiamo il numero di atomi degli elementi.
Nota che se mettiamo lo stesso coefficiente insieme alla formula per l'acqua, abbiamo la stessa quantità di atomi su entrambi i lati.
Pertanto, l'equazione chimica correttamente bilanciata è 2H2oh2 → Il2 + 2H2O.
domanda 4
(UFPE) Considera le reazioni chimiche di seguito.
Possiamo dire che:
a) tutti sono equilibrati.
b) 2, 3 e 4 sono bilanciati.
c) solo 2 e 4 sono bilanciati.
d) solo 1 è sbilanciato.
e) nessuno è correttamente bilanciato, perché gli stati fisici dei reagenti e dei prodotti sono diversi.
Alternativa b) 2, 3 e 4 sono bilanciati.
Le alternative 1 e 5 non sono corrette perché:
- L'equazione 1 è sbilanciata, il saldo corretto sarebbe:
- L'equazione 5 non è corretta perché il composto formato nella reazione sarebbe H2SOLO3.
Per formare l'H2SOLO4 dovrebbe essere inclusa nell'equazione l'ossidazione di SO2.
domanda 5
(Mackenzie-SP) Riscaldato a 800 °C, il carbonato di calcio si decompone in ossido di calcio (calce vergine) e anidride carbonica. L'equazione correttamente bilanciata, che corrisponde al fenomeno descritto, è:
(Dato: Ca - metallo alcalino terroso.)
Alternativa c)
Il calcio è un metallo alcalino terroso e per avere stabilità il calcio necessita di 2 elettroni (Ca2+), che è la carica di ossigeno (O2-).
Pertanto, un atomo di calcio si lega a un atomo di ossigeno e il composto formato è CaO, che è calce viva.
L'altro prodotto è l'anidride carbonica (CO2). Entrambi sono formati da carbonato di calcio (CaCO3).
Mettendolo in un'equazione:
Notiamo che le quantità di atomi sono già corrette e non necessitano di bilanciamento.
domanda 6
(UFMG) L'equazione non è equilibrato. Bilanciandolo con i numeri più piccoli possibili, la somma dei coefficienti stechiometrici sarà:
a) 4
b) 7
c) 10
d) 11
e) 12
Alternativa e) 12
Utilizzando il metodo di prova, l'ordine di bilanciamento sarà:
1° passo: Poiché l'elemento che appare solo una volta in ogni membro e ha l'indice più alto è il calcio, abbiamo iniziato a bilanciarlo.
2° passo: Seguiamo il bilanciamento dal radicale PO43-, che appare anche solo una volta.
3° passo: bilanciamo l'idrogeno.
Con ciò, osserviamo che automaticamente la quantità di ossigeno è stata regolata e il saldo dell'equazione è:
Ricordando che quando il coefficiente è 1 non è necessario scriverlo nell'equazione.
Sommando i coefficienti abbiamo:
domanda 7
La combustione è un tipo di reazione chimica in cui l'energia viene rilasciata sotto forma di calore.
Nella combustione completa di una sostanza formata da carbonio e idrogeno, si formano anidride carbonica e acqua.
Osserva le reazioni di combustione degli idrocarburi e rispondi quale delle seguenti equazioni è bilanciata in modo errato:
a) CH4 + 2O2 → CO2 + 2H2oh
avanti Cristo3H8 +502 → 3CO2 + 4H2oh
c) C4H10 +13/3O2 → 4CO2 + 5h2oh
d) C2H6 + 7/2O2 → 2CO2 + 3H2oh
Risposta errata: c) C4H10 +13/3O2 → 4CO2 + 5h2oh
Per bilanciare le equazioni chimiche, diamo prima un'occhiata a quale elemento appare solo una volta in ogni membro dell'equazione.
Si noti che il carbonio e l'idrogeno formano solo un reagente e un prodotto in ciascuna equazione presentata.
Quindi iniziamo a bilanciare con l'idrogeno, poiché ha un numero maggiore di atomi.
Pertanto, l'ordine di bilanciamento sarà:
- Idrogeno
- Carbonio
- Ossigeno
Idrogeno
Poiché il prodotto ha 2 atomi di idrogeno, inseriamo come coefficiente un numero che moltiplicato per 2 dà come risultato il numero di atomi di idrogeno del reagente.
a) CH4 + O2 → CO2 + 2H2oh
avanti Cristo3H8 + O2 → CO2 + 4H2oh
c) C4H10 + O2 → CO2 + 5H2oh
d) C2H6 + O2 → CO2 + 3H2oh
Carbonio
Il bilanciamento avviene trasponendo l'indice di carbonio nel reagente e utilizzandolo come coefficiente sul prodotto che ha atomi di questo elemento.
a) CH4 + O2 → 1CO2 + 2H2oh
avanti Cristo3H8 + O2 → 3CO2 + 4H2oh
c) C4H10 + O2 → 4CO2 + 5h2oh
d) C2H6 + O2 → 2CO2 + 3H2oh
Ossigeno
Sommando il numero di atomi di ossigeno nei prodotti formati troviamo il numero di atomi dell'elemento che deve reagire.
Per questo, dobbiamo mettere come coefficiente un numero che moltiplicato per 2 risulta nel numero di atomi di ossigeno nei prodotti.
a) CH4 + O2 → 1CO2 + 2H2oh
2x = 2 + 2
2x = 4
x = 2
Quindi l'equazione corretta è: CH4 + 2oh2 → 1CO2 + 2H2O.
avanti Cristo3H8 + O2 → 3CO2 + 4H2oh
2x = 6 + 4
2x = 10
x = 5
Quindi l'equazione corretta è: C3H8 + 5oh2 → 3CO2 + 4H2oh
c) C4H10 + O2 → 4CO2 + 5h2oh
2x = 8 + 5
2x = 13
x = 13/2
Quindi l'equazione corretta è: C4H10 + 13/2oh2 → 4CO2+ 5h2oh
d) C2H6 + O2 → 2CO2 + 3H2oh
2x = 4 + 3
2x = 7
x = 7/2
Quindi l'equazione corretta è: C2H6 + 7/2oh2 → 2CO2 + 3H2oh
Le equazioni correttamente bilanciate sono:
a) CH4 + 2O2 → CO2 + 2H2oh
avanti Cristo3H8 +502 → 3CO2 + 4H2oh
c) C4H10 + 13/2O2 → 4CO2 + 5h2oh
d) C2H6 + 7/2O2 → 2CO2 + 3H2oh
Quindi, alternativa c) C4H10 +13/3O2 → 4CO2 + 5h2Il fatto è che non ha il giusto equilibrio.
domanda 8
(Enem 2015) I calcari sono materiali composti da carbonato di calcio, che possono fungere da assorbenti per l'anidride solforosa (SO2), un importante inquinante atmosferico. Le reazioni coinvolte nel processo sono l'attivazione del calcare, tramite calcinazione, e la fissazione di SO2 con la formazione di un sale di calcio, come illustrato dalle equazioni chimiche semplificate.
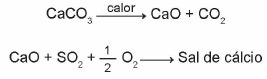
Considerando le reazioni coinvolte in questo processo di desolforazione, la formula chimica del sale di calcio corrisponde a:
Alternativa b)
Poiché la reazione è equilibrata, gli atomi contenuti nei reagenti devono trovarsi nella stessa quantità nei prodotti. Così,
Il sale formato è composto da:
1 atomo di calcio = Ca
1 atomo di zolfo = S
4 atomi di ossigeno = O4
Pertanto, la formula chimica del sale di calcio corrisponde a CaSO4.
domanda 9
(UFPI) La reazione di X con Y è mostrata di seguito. Determina quale equazione rappresenta meglio l'equazione chimica bilanciata.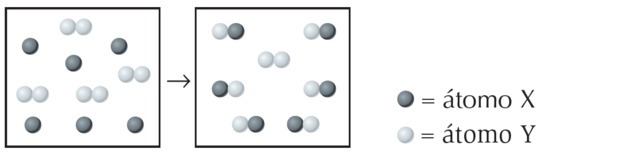
Alternativa a)
Nella figura osserviamo che la specie X è un singolo atomo mentre Y è biatomica, cioè è formata dall'unione di 2 atomi. Quindi X reagisce con Y2.
Il prodotto formato è rappresentato da XY, l'equazione essendo sbilanciata:
Bilanciamo l'equazione come segue:
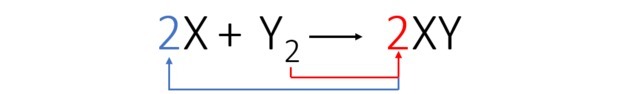
Secondo l'equazione bilanciata, la figura seguente ci mostra come avviene la reazione e la sua proporzione.
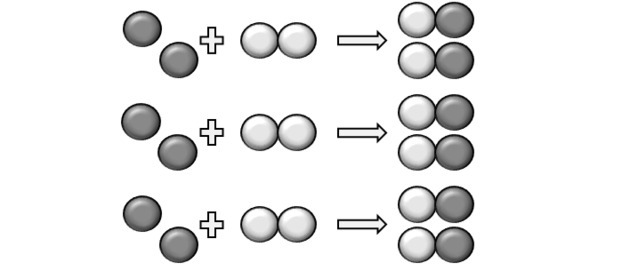
Perché avvenga una reazione deve esserci un rapporto fisso e quindi alcuni composti potrebbero non reagire. Questo è ciò che mostra la figura, perché nel prodotto vediamo che un Y2 non ha reagito.
domanda 10
(Enem 2010) Sono sempre più frequenti le mobilitazioni per promuovere un pianeta migliore per le generazioni future. La maggior parte dei mezzi di trasporto di massa è attualmente alimentata dalla combustione di un combustibile fossile. Per fare un esempio dell'onere causato da questa pratica, basti sapere che un'auto produce, in media, circa 200g di anidride carbonica per km percorso.
Rivista sul riscaldamento globale. Anno 2, 8. Pubblicazione dell'Instituto Brasileiro de Cultura Ltda.
Uno dei principali costituenti della benzina è l'ottano (C8H18). Attraverso la combustione dell'ottano è possibile l'energia, permettendo all'auto di mettersi in movimento. L'equazione che rappresenta la reazione chimica di questo processo dimostra che:
a) l'ossigeno viene rilasciato nel processo, sotto forma di O2.
b) il coefficiente stechiometrico per l'acqua è di 8 a 1 ottano.
c) nel processo c'è consumo di acqua, in modo che l'energia venga rilasciata.
d) il coefficiente stechiometrico per l'ossigeno è da 12,5 a 1 ottano.
e) il coefficiente stechiometrico per l'anidride carbonica è da 9 a 1 ottano
Alternativa d) il coefficiente stechiometrico per l'ossigeno è da 12,5 a 1 ottano.
Quando bilanciamo l'equazione troviamo i seguenti coefficienti:
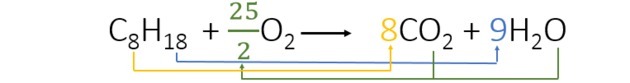
- Abbiamo avviato il bilanciamento dell'idrogeno che compare solo una volta in ogni membro e ha un indice più alto. Poiché ci sono 18 atomi di idrogeno che reagiscono, ce ne sono 2 nel prodotto, quindi dobbiamo aggiungere un numero che moltiplicato per 2 dà 18. Quindi 9 è il coefficiente.
- Quindi aggiungiamo il coefficiente 8 davanti alla CO2 avere 8 atomi di carbonio in ogni membro dell'equazione.
- Infine, basta aggiungere la quantità di ossigeno nel prodotto e trovare il valore che moltiplicato per 2 ci dà 25 atomi di ossigeno. Quindi abbiamo scelto 25/2 o 12.5.
Pertanto, per la combustione di 1 ottano viene consumato 12,5 ossigeno.
domanda 11
(Fatec-SP) Una caratteristica essenziale dei fertilizzanti è la loro solubilità in acqua. Pertanto, l'industria dei fertilizzanti trasforma il fosfato di calcio, la cui solubilità in acqua è molto bassa, in un composto molto più solubile, che è il perfosfato di calcio. Questo processo è rappresentato dall'equazione:
dove i valori di x, y e z sono, rispettivamente:
a) 4, 2 e 2.
b) 3, 6 e 3.
c) 2, 2 e 2.
d) 5, 2 e 3.
e) 3, 2 e 2.
Alternativa e) 3, 2 e 2.
Usando il metodo algebrico, formiamo equazioni per ciascun elemento e identifichiamo il numero di atomi nel reagente con il numero di atomi nel prodotto. Perciò:
Equazione bilanciata:
domanda 12
Bilancia le equazioni seguenti usando il metodo di prova.
Rispondere:
L'equazione è composta dagli elementi idrogeno e cloro. Bilanciamo gli elementi semplicemente aggiungendo il coefficiente 2 davanti al prodotto.
L'equazione non aveva bisogno di essere bilanciata, poiché le quantità di atomi sono già state regolate.
Il fosforo ha due atomi nei reagenti, quindi per bilanciare questo elemento regoliamo la quantità di acido fosforico nel prodotto a 2H3POLVERE4.
Dopodiché, abbiamo osservato che l'idrogeno aveva 6 atomi nel prodotto, abbiamo bilanciato la quantità di questo elemento aggiungendo il coefficiente 3 al reagente che lo contiene.
Con i passaggi precedenti, la quantità di ossigeno è stata corretta.
Guardando l'equazione vediamo che le quantità di idrogeno e bromo nei prodotti sono il doppio di quanto se c'è nei reagenti, quindi aggiungiamo il coefficiente 2 all'HBr per bilanciare questi due elementi.
Il cloro ha 3 atomi nei prodotti e solo 1 nei reagenti, quindi bilanciamo mettendo un coefficiente di 3 prima dell'HCl.
L'idrogeno aveva 3 atomi nei reagenti e 2 atomi nei prodotti. Per aggiustare le quantità trasformiamo l'indice H2 in coefficiente, moltiplichiamo per il 3 che era già nell'HCl e otteniamo il risultato di 6HCl.
Regoliamo le quantità di cloro nei prodotti per avere anche 6 atomi e ottenere 2AlCl3.
L'alluminio aveva 2 atomi nei prodotti, abbiamo regolato la quantità nei reagenti a 2Al.
Bilanciamo la quantità di idrogeno nel prodotto a 3H2 e adattiamo la quantità di 6 atomi di quell'elemento in ogni termine dell'equazione.
Nell'equazione il radicale nitrato (NO3-) ha indice 2 nel prodotto, trasformiamo l'indice in coefficiente nel reagente per 2AgNO3.
La quantità di argento doveva essere regolata, poiché ora ha 2 atomi nei reagenti, quindi abbiamo 2Ag nel prodotto.
Nei reagenti abbiamo 4 atomi di idrogeno e per bilanciare questo elemento aggiungiamo il coefficiente 2 al prodotto HCl.
Il cloro ora ha 4 atomi nei prodotti, quindi regoliamo la quantità nel reagente a 2Cl2.
Abbiamo 6 atomi di idrogeno nei reagenti e per bilanciare questo elemento regoliamo la quantità di acqua a 3H2O.
Abbiamo 2 atomi di carbonio nei reagenti e per bilanciare questo elemento regoliamo la quantità di anidride carbonica a 2CO2.
L'ossigeno deve avere 7 atomi nei reagenti e per bilanciare questo elemento regoliamo la quantità di ossigeno molecolare a 3O2.
Guardando l'equazione, il radicale nitrato (NO3-) ha indice 2 nel prodotto. Trasformiamo l'indice in coefficiente 2 nel reagente AgNO3.
Abbiamo 2 atomi d'argento nei reagenti e per bilanciare questo elemento regoliamo la quantità di cloruro d'argento nel prodotto a 2AgCl.
Abbiamo 3 atomi di calcio nel prodotto e per bilanciare questo elemento regoliamo la quantità di nitrato di calcio nel reagente a 3Ca (NO3)2.
Rimaniamo quindi con 6 radicali NO3- nei reagenti e per bilanciare questo radicale regoliamo la quantità di acido nitrico nei prodotti a 6HNO3.
Ora abbiamo 6 atomi di idrogeno nei prodotti e per bilanciare questo elemento regoliamo la quantità di acido fosforico nel reagente a 2H3POLVERE4.
Ulteriori informazioni sui calcoli con equazioni chimiche su:
- Bilanciamento delle equazioni chimiche
- Stechiometria
- Calcoli stechiometrici
- Esercizi di stechiometria
- Esercizi di tavola periodica