La solubilità è la proprietà fisica delle sostanze di dissolversi o meno in un dato liquido.
è chiamato soluto, composti chimici che si dissolvono in un'altra sostanza. oh solvente è la sostanza in cui il soluto verrà sciolto per formare un nuovo prodotto.
IL dissoluzione chimica è il processo di dispersione del soluto in un solvente, dando origine a una soluzione o miscela omogenea.
I soluti possono essere classificati in:
- Solubile: sono i soluti che si dissolvono nel solvente.
- Leggermente solubile: sono i soluti che sono difficili da sciogliere nel solvente.
- Insolubile: sono i soluti che non si dissolvono nel solvente.
Un principio comune nella solubilità è: "come dissolversi come”. Ciò significa che un soluto polare tende a dissolversi in un solvente polare. Lo stesso vale per le sostanze non polari.
Vedi alcuni esempi:
- Gli idrocarburi, composti presenti nella benzina, sono apolari e hanno poca solubilità in acqua, che è polare.
- Gli alcoli, come l'etanolo e il metanolo, sono polari per la presenza di ossigeno nella catena del carbonio e, quindi, sono solubili in acqua.
- I sali hanno diversa solubilità. Si possono classificare in: sale solubile e sale praticamente insolubile.
Coefficiente di solubilità
oh coefficiente di solubilità (Cs) determina la capacità massima del soluto che si dissolve in una data quantità di solvente. Questo, a seconda delle condizioni di temperatura.
In sintesi, il coefficiente di solubilità è la quantità di soluto necessaria per saturare una quantità standard di solvente in una data condizione.
Si consideri ad esempio la seguente situazione:
In un bicchiere di acqua salata (NaCl), inizialmente, il sale scompare nell'acqua.
Tuttavia, se si aggiunge più sale, a un certo punto inizierà ad accumularsi sul fondo del bicchiere.
Questo perché l'acqua, che è il solvente, ha raggiunto il suo limite di solubilità e la massima concentrazione. Questo è anche chiamato Punto di saturazione.
Il soluto che rimane sul fondo del contenitore e non si dissolve è chiamato corpo di fondo o precipitato.
In relazione con Punto di saturazione, le soluzioni sono classificate in tre tipologie:
- soluzione insatura: quando la quantità di soluto è inferiore a Cs.
- soluzione satura: quando la quantità di soluto è esattamente la stessa di Cs. È il limite di saturazione.
- soluzione supersatura: quando la quantità di soluto è maggiore di Cs.
Prodotto di solubilità
Come abbiamo visto, la solubilità rappresenta la quantità di soluto disciolto in una soluzione. oh prodotto di solubilità (Kps) è una costante di equilibrio direttamente correlata alla solubilità.
Il suo calcolo consente di determinare se una soluzione è satura, insatura o satura di un precipitato. Questo calcolo è correlato all'equilibrio di dissoluzione e alla concentrazione di ioni nella soluzione.
Questo perché il prodotto di solubilità si riferisce all'equilibrio di dissoluzione delle sostanze ioniche.
capire di più su Soluto e Solvente.
Curva di solubilità
La capacità di solubilità chimica di una sostanza soggetta a variazione di temperatura non è lineare. La variazione della capacità di solubilità, in funzione della temperatura, è nota come curva di solubilità.
La maggior parte delle sostanze solide ha il coefficiente di solubilità aumentato con l'aumentare della temperatura. Pertanto, la solubilità di ciascun materiale avviene in modo proporzionale, a seconda della temperatura.
Ogni sostanza ha la propria curva di solubilità per un particolare solvente.
La variazione di solubilità è considerata lineare quando non è sotto l'influenza della temperatura. Per conoscere la variazione è necessario osservare la curva di solubilità.
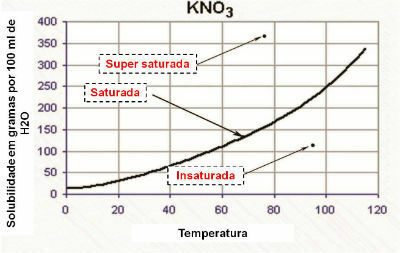
Curva di solubilità
Nel grafico, la curva di solubilità dimostra che la soluzione è:
- saturato: quando il punto si trova sulla curva di solubilità.
- insaturo: quando il punto è al di sotto della curva di solubilità.
- omogeneamente saturo: quando il punto è al di sopra della curva di solubilità.
Leggi anche su Concentrazione della soluzione.
Formula del coefficiente di solubilità
La formula per calcolare il coefficiente di solubilità è:
Cs = 100. m1/m2
Dove:
Cs: coefficiente di solubilità
m1: massa di soluto
m2: massa solvente
Voglio sapere di più? leggere Soluzioni chimiche e Diluizione delle soluzioni.
Esercizi
1. (Favest-SP) Un chimico legge le seguenti istruzioni in una procedura descritta nella sua guida di laboratorio:
"Sciogliere 5,0 g di Cloruro in 100 mL di acqua a temperatura ambiente..." .
Tra le sostanze sottostanti, quale è menzionata nel testo?
a) Cl2.
b) CCl4.
c) NaClO.
d) NH4cl.
e) AgCl.
d) NH4cl.
2. (UFRGS-RS) Un dato sale ha una solubilità in acqua pari a 135 g/L a 25°C. Sciogliendo completamente 150 g di questo sale in un litro d'acqua, a 40°C, e raffreddando lentamente il sistema a 25°C, si ottiene un sistema omogeneo la cui soluzione sarà:
a) diluito.
b) concentrato.
c) insaturo.
d) saturo.
e) sovrasaturato.
e) sovrasaturato.
3. (Mackenzie-SP) Un tipico esempio di soluzione sovrasatura è:
L'acqua minerale.
b) siero fatto in casa.
c) soda in un contenitore chiuso.
d) alcol 46° GL.
e) aceto.
c) soda in un contenitore chiuso.
4. (PUC-RJ) Si noti la figura sottostante, che rappresenta la solubilità, in g per 100 g di H2O, di 3 sali inorganici in un determinato intervallo di temperatura:
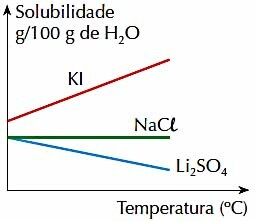
Controlla l'affermazione corretta:
a) La solubilità dei 3 sali aumenta con la temperatura.
b) L'aumento della temperatura favorisce la solubilizzazione del Li2SOLO4.
c) La solubilità di KI è maggiore delle solubilità di altri sali, nell'intervallo di temperatura mostrato.
d) La solubilità di NaCl varia con la temperatura.
e) La solubilità di 2 sali diminuisce con la temperatura.
c) La solubilità di KI è maggiore delle solubilità di altri sali, nell'intervallo di temperatura mostrato.



