IL batteria è un sistema in cui avviene la reazione di ossidoriduzione. In questo dispositivo, l'energia chimica prodotta nella reazione spontanea viene convertita in energia elettrica.
Le reazioni di ossidazione e riduzione avvengono simultaneamente in una cellula. Quando una specie subisce l'ossidazione, dona elettroni all'altra specie, che, ricevendoli, subisce una riduzione.
Pertanto, quello che subisce l'ossidazione è l'agente riducente e quello che subisce la riduzione è l'agente ossidante.
IL ossidazione si verifica quando una specie perde elettroni e diventa un catione: A → A+ + e-.
IL riduzione si verifica quando una specie acquista elettroni e diventa elettricamente neutra: B+ + e- → B.
Nelle equazioni chimiche, questo trasferimento di elettroni è dimostrato dalla variazione del numero di ossidazione (nox).
Le reazioni di riduzione avvengono all'interno delle cellule e la corrente elettrica nasce con la migrazione degli elettroni dal polo negativo a quello positivo.

Come funziona una pila?
Uno reazione redox può essere generalmente rappresentato dall'equazione:
A+B+ → A+ + B
Dove,
A: sostanza che si ossida, perde elettroni, aumenta il suo valore ed è l'agente riducente.
B: sostanza che subisce riduzione, acquista elettroni, diminuisce l'ossidazione ed è l'agente ossidante.
Vedi nell'immagine seguente come può essere rappresentato questo processo.
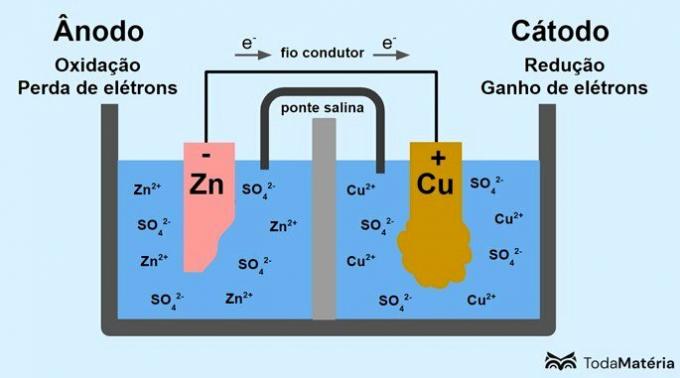
Il sistema diviso in due semicelle e formato da due elettrodi metallici collegati esternamente da un filo conduttore fu sviluppato da John Frederic Daniell (1790-1845) nel 1836.
La batteria è composta da due elettrodi, collegati da un filo conduttore, e un elettrolita, dove si trovano gli ioni. L'elettrodo è la superficie conduttiva solida che permette lo scambio di elettroni.
anodo: elettrodo in corrispondenza del quale avviene l'ossidazione. È anche il polo negativo della batteria.
catodo: elettrodo in corrispondenza del quale avviene la riduzione. È anche il polo positivo della batteria.
Nell'immagine sopra, lo zinco metallico è l'anodo e subisce il ossidazione. Il rame metallico è il catodo e subisce una riduzione. La migrazione degli elettroni (e-) avviene dall'anodo al catodo attraverso il filo conduttivo.
Le reazioni che si verificano nel sistema di immagini sono:
- anodo (ossidazione): Zn(S) → Zn2(qui) + 2e-
- catodo (riduzione): Cu2+(qui) + 2e- → culo(S)
- equazione generale: Zn(S) + culo2+(qui) → culo(S) + Zn2+(qui)
Lo zinco è un metallo con una maggiore tendenza a perdere elettroni e, quindi, nella soluzione si formano cationi. L'elettrodo di zinco inizia a consumarsi e a perdere massa perché lo zinco viene rilasciato in soluzione quando si formano cationi Zn2+.
Gli elettroni provenienti dall'anodo arrivano al catodo ed i cationi metallici, ricevendoli, si trasformano in rame metallico, che si deposita sull'elettrodo e ne aumenta la massa.
Il ponte salino è una corrente ionica responsabile della circolazione degli ioni nel sistema per mantenerlo elettricamente neutro.
Leggi anche su numero di ossidazione (nox).
tipi di batteria
In una cellula, la tendenza delle specie chimiche a ricevere o donare elettroni è determinata dal potenziale di riduzione.
La componente con il potenziale di riduzione più alto tende a subire una riduzione, cioè ad acquisire elettroni. La specie con il potenziale di riduzione più basso e, di conseguenza, il potenziale di ossidazione più alto, tende a trasferire elettroni.
Ad esempio, nella reazione redox Zn0(S) + culo2+(qui) → culo0(S) + Zn2+(qui)
Lo zinco si ossida e dona elettroni perché ha un potenziale di riduzione E0 = -0,76V, inferiore al potenziale di riduzione del rame E0 = +0,34V e, quindi, riceve elettroni e subisce una riduzione.
Vedi sotto per altri esempi di pile.
Pila di zinco e idrogeno
Semireazione di ossidazione: Zn(S) → Zn2+ + 2e- (E0 = -0,76 V)
Semireazione di riduzione: 2H+(qui) + 2e- → H2(g) (E0 =0,00V)
Equazione globale: Zn(S) + 2 ore+(qui) → Zn2+(qui) + H2(g)
Rappresentazione dello stack:
Cella di rame e idrogeno
Semireazione di ossidazione: H2(g) → 2 ore+(qui) + 2e- (E0 = 0,00 V)
Semireazione di riduzione: Cu2+(qui) + 2e- → culo(S) (E0 = +0,34 V)
Equazione globale: Cu2+(qui) + H2(g) → 2 ore+(qui) + culo(S)
Rappresentazione dello stack:
Ottieni maggiori conoscenze sull'argomento con i contenuti:
- elettrochimica
- Elettrolisi
Riferimenti bibliografici
FONSECA, M. R. M. Chimica, 2. 1. ed. San Paolo: Attica, 2013.
SANTOS, WLP; MOL, GS Chimica dei cittadini, 3. 2. ed. San Paolo: Editora AJS, 2013.
USBERCO, J. Collegare la chimica, 2: la chimica. - 2. ed. San Paolo: Saraiva, 2014.