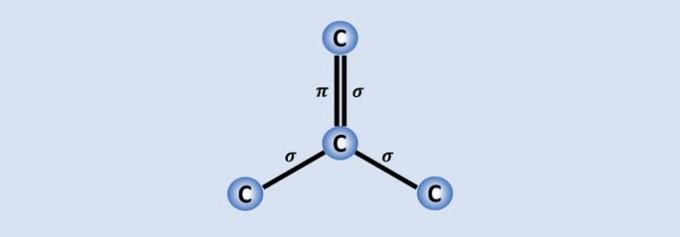
La molecola è un raggruppamento stabile di due o più atomi, uguali o diversi, uniti tramite legami covalenti.
I composti molecolari sono classificati in base alla polarità.
- Molecole apolari: non c'è differenza di elettronegatività tra gli atomi.
- Molecole polari: esiste una differenza di elettronegatività tra gli atomi, con polo positivo e polo negativo.
Quando la molecola è formata da più di un elemento chimico, il numero di nubi elettroniche e ligandi all'atomo centrale determina la polarità.
molecole non polari
Le molecole hanno i loro atomi uniti da legami covalenti, cioè gli elettroni sono condivisi.
elettronegatività è la capacità di un atomo di attrarre a sé gli elettroni in un legame, formando i poli nella molecola.
L'atomo che attrae gli elettroni diventa il polo negativo, per accumulo di carica negativa, e l'altro atomo diventa il polo positivo.
Quando una molecola è formata da atomi di un singolo elemento chimico, non c'è differenza di elettronegatività e la molecola è apolate.

Le molecole di sostanze semplici come O2 e no2, sono formati da atomi dello stesso elemento; le molecole delle sostanze composite, invece, hanno almeno due elementi diversi.

A molecole CO2 e BeH2 sono anche non polari a causa della geometria. Poiché entrambi hanno geometria lineare, gli atomi alle estremità, ossigeno e idrogeno, attraggono gli elettroni del legame l'uno verso l'altro, poiché sono più elettronegativi.
L'attrazione dell'atomo a sinistra è controbilanciata dall'attrazione dell'atomo a destra. Poiché i legami sono uguali, cioè hanno la stessa intensità ma direzioni diverse, le molecole non formano poli.
molecole polari
Quando una molecola è formata da atomi diversi c'è una differenza di elettronegatività, ma è la geometria della molecola che determina se sarà polare o non polare.

In entrambi gli esempi, vediamo che gli atomi centrali, ossigeno e azoto, hanno coppie di elettroni spaiate che formano nuvole di elettroni.
Poiché ci sono più nubi di elettroni attorno all'atomo centrale di quanti atomi siano uguali ad esso attaccati, la molecola è polare.
Con la formazione di una nuvola elettronica, la molecola assume una struttura che meglio accoglie gli atomi e, quindi, la geometria dell'acqua è angolare e piramidale dell'ammoniaca.
Vuoi arricchire le tue conoscenze? Non perderti i testi qui sotto!
- Biomolecole
- forze intermolecolari
- formula molecolare
- Massa molecolare
Esercizio con feedback commentato
1. Indicare la polarità delle molecole:

a) Apolare. La molecola è costituita da un unico elemento chimico, il cloro. Poiché non c'è differenza di elettronegatività, non si formano poli.
b) Polare. Ci sono 4 nuvole di elettroni e 2 atomi uguali (H) attaccati all'elemento centrale (S).
c) Polare. Ci sono 3 nuvole elettroniche e 2 atomi uguali (O) attaccati all'elemento centrale (S).
d) Polare. Gli elementi della molecola hanno elettronegatività diverse. Nello iodio si forma un polo negativo a causa dell'accumulo di carica negativa, e di conseguenza il lato idrogeno forma un polo positivo.
e) Polare. Ci sono 4 nuvole di elettroni e 3 atomi uguali (Cl) attaccati all'elemento centrale (P).
f) Polare. C'è una distribuzione asimmetrica delle cariche sulla molecola, poiché il carbonio ha diversi ligandi.
g) Apolare. La molecola è biatomica e composta da atomi dello stesso elemento chimico, quindi non c'è differenza di elettronegatività.
h) Apolare. Il numero di nuvole di elettroni è uguale al numero di atomi attaccati all'atomo centrale.
i) Apolare. Il numero di nuvole di elettroni è uguale al numero di atomi attaccati all'atomo centrale.
2. (Favest) Consideriamo le molecole di HF, HCl, H2O, H2, O2 e CH4.
a) Classificare queste molecole in due gruppi: polari e non polari.
| Polare | apolare |
|---|---|
| Acido fluoridrico (HF) | Idrogeno molecolare (H2) |
| Cloruro di idrogeno (HCl) | Ossigeno molecolare (O2) |
| Acqua (H2o) | Metano (CH4) |
HF, HCl e H2Sono polari perché nei tre composti l'idrogeno è legato ad elementi molto elettronegativi.
H2 è il2 sono non polari, poiché non c'è differenza di elettronegatività nelle molecole. il CH4 è anche non polare perché il numero di nubi di elettroni è uguale al numero di elementi attaccati all'atomo centrale, il carbonio.
Proprietà riferita all'atomo: elettronegatività.
Le molecole costituite da atomi di un solo elemento chimico sono state classificate come non polari, in quanto non vi è alcuna differenza di elettronegatività.
Proprietà relative alla molecola: quantità di nuvole e numero di ligandi uguali.
Le molecole formate da atomi di diversi elementi chimici sono state classificate come polari o non polari in base al numero di nuvole elettroniche e alla quantità di ligandi all'atomo centrale.
L'acqua è polare perché l'atomo centrale, l'ossigeno, ha una coppia di elettroni spaiati, causando la presenza di 3 nuvole di elettroni e 2 ligandi. Pertanto, la distribuzione delle cariche è asimmetrica, formando poli nella molecola.
Il metano è apolare, in quanto l'atomo centrale, il carbonio, ha un numero di leganti pari al numero di nuvole elettroniche, rendendo la geometria tetraedrica e non essendoci polarità nella molecola.
3. (Vunesp) Tra le alternative sottostanti, indicare quella con l'affermazione errata:
a) Il legame covalente è quello che si verifica attraverso la condivisione di elettroni tra due atomi.
b) Il composto covalente HCl è polare, a causa della differenza di elettronegatività esistente tra gli atomi di idrogeno e di cloro.
c) Il composto formato tra un metallo alcalino e un alogeno è covalente.
d) La sostanza di formula Br2 non è polare.
e) La sostanza della formula Cal2 è ionico.
Alternativa errata: c) Il composto formato tra un metallo alcalino e un alogeno è covalente.
a) CORRETTO. Questo tipo di legame corrisponde alla condivisione di elettroni generalmente tra non metalli.
b) CORRETTO. Il cloro ha una maggiore elettronegatività dell'idrogeno e, quindi, attrae a sé la coppia di elettroni del legame, provocando uno squilibrio di carica.
La molecola di HCl è polare perché nel cloro si forma un polo negativo a causa dell'accumulo di carica negativa e, di conseguenza, il lato idrogeno tende ad avere una carica positiva accumulata, formando un polo positivo.
c) ERRATO. Attraverso i legami ionici, i metalli sono in grado di donare elettroni e rimanere caricati positivamente, formando cationi; gli alogeni, invece, ricevono elettroni e formano anioni, specie con carica negativa.
d) CORRETTO. La molecola è biatomica e composta da atomi dello stesso elemento chimico, quindi non c'è differenza di elettronegatività.
e) CORRETTO. Nel legame ionico, gli elettroni vengono donati o ricevuti dagli atomi. Nel composto ionico, il calcio dona due elettroni e forma il catione Ca2+. Lo iodio riceve elettroni dal calcio e forma una specie carica negativamente, I2-.
Assicurati di controllare questi testi su questioni relative all'argomento di questo contenuto:
- legami ionici
- legami covalenti
- Polarità delle connessioni
- Sostanze semplici e composte
- Proprietà generali della materia