Il grafene è un nanomateriale composto solo da carbonio, in cui gli atomi si legano tra loro formando strutture esagonali.
È il cristallo più fine conosciuto e le sue proprietà lo rendono altamente desiderabile. Questo materiale è leggero, conduttore di elettricità, rigido e impermeabile.
L'applicabilità del grafene è in diverse aree. I più noti sono: edilizia civile, energia, telecomunicazioni, medicina ed elettronica.
Da quando è stato scoperto, il grafene è rimasto al centro dell'interesse della ricerca. Lo studio delle applicazioni di questo materiale mobilita istituzioni e investimenti di milioni di euro. Quindi gli scienziati di tutto il mondo continuano a cercare di sviluppare un modo più economico per produrlo su larga scala.
Capire cos'è il grafene
Il grafene è una forma allotropica del carbonio, dove la disposizione degli atomi di questo elemento forma uno strato sottile.
Questo allotropo è bidimensionale, cioè ha solo due misure: larghezza e altezza.
Per avere un'idea delle dimensioni di questo materiale, lo spessore di un foglio di carta corrisponde alla sovrapposizione di 3 milioni di strati di grafene.
Sebbene sia il materiale più sottile isolato e identificato dall'uomo, la sua dimensione è dell'ordine dei nanometri. È leggero e resistente, in grado di condurre l'elettricità meglio di metalli come rame e silicio.
La disposizione che gli atomi di carbonio assumono nella struttura del grafene fa sì che in esso si trovino caratteristiche molto interessanti e desiderabili.
Applicazioni del grafene
Molte aziende e gruppi di ricerca in tutto il mondo stanno pubblicando i risultati del lavoro che coinvolge le applicazioni del grafene. Vedi sotto i principali.
| Acqua potabile | Le membrane a forma di grafene sono in grado di desalinizzare e purificare l'acqua di mare. |
|---|---|
| Emissioni di CO2 | I filtri in grafene sono in grado di ridurre le emissioni di CO2 separando i gas generati da industrie e imprese che verranno respinti. |
| rilevamento della malattia | Sensori biomedici molto più veloci si basano sul grafene e possono rilevare malattie, virus e altre tossine. |
| Costruzione | I materiali da costruzione come il cemento e l'alluminio sono resi più leggeri e resistenti con l'aggiunta di grafene. |
| bellezza | Colorazione dei capelli mediante spruzzatura di grafene, la cui durata sarebbe di circa 30 lavaggi. |
| Microdispositivi | Chip ancora più piccoli e resistenti grazie alla sostituzione del silicio con il grafene. |
| Energia | Le celle solari hanno una migliore flessibilità, più trasparenza e minori costi di produzione con l'uso del grafene. |
| Elettronica | Le batterie con un accumulo di energia migliore e più veloce possono ricaricarsi in un massimo di 15 minuti. |
| Mobilità | Le biciclette possono avere pneumatici e telai più rigidi del peso di 350 grammi utilizzando il grafene. |
Struttura del grafene
La struttura del grafene è costituita da una rete di atomi di carbonio collegati in esagoni.
Il nucleo di carbonio è composto da 6 protoni e 6 neutroni. I 6 elettroni dell'atomo sono distribuiti in due strati.
A strato di valenza ci sono 4 elettroni, con questo guscio che ne contiene fino a 8. Pertanto, affinché il carbonio acquisisca stabilità, deve effettuare 4 connessioni e raggiungere la configurazione elettronica di un gas nobile, come indicato nella regola dell'ottetto.
Gli atomi nel legame di grafene da legami covalenti, cioè c'è la condivisione di elettroni.

I legami carbonio-carbonio sono i legami più forti che si trovano in natura e ogni carbonio si unisce agli altri 3 nella struttura. Pertanto, l'ibridazione dell'atomo è sp2, che corrisponde a 2 legami singoli e uno doppio.
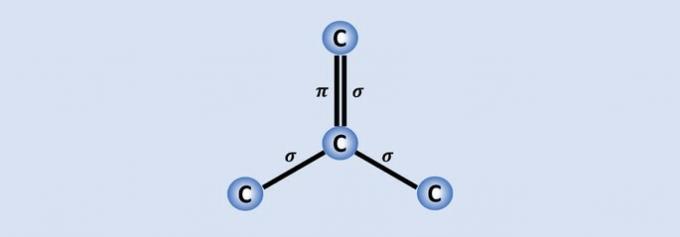
Dei 4 elettroni di carbonio, tre sono condivisi con gli atomi vicini e uno, che costituisce il legame. , aiuta il grafene, ad esempio, ad essere un buon conduttore di elettricità perché ha più "libertà" nel materiale.
Proprietà del grafene

| Leggero | Un metro quadrato pesa solo 0,77 milligrammi. Un aerogel di grafene è circa 12 volte più leggero dell'aria. |
|---|---|
| Flessibile | Può espandersi fino al 25% della sua lunghezza. |
| Conduttore | La sua densità di corrente è superiore al rame. |
| Durevole | Si espande a freddo e si restringe a caldo. La maggior parte delle sostanze agisce in modo opposto. |
| Impermeabile | La maglia formata dai carboni non permette nemmeno il passaggio di un atomo di elio. |
| Resistente | Circa 200 volte più resistente dell'acciaio. |
| Traslucido | Assorbe solo il 2,3% della luce. |
| Magro | Un milione di volte più sottile di un capello umano. Il suo spessore è di un solo atomo. |
| Difficile | Il materiale più duro conosciuto, ancor più del diamante. |
Storia e scoperta del grafene
Il termine grafene è stato utilizzato per la prima volta nel 1987, ma è stato riconosciuto ufficialmente solo nel 1994 dall'União de Química Pure and Applied.
Questa designazione è nata dalla giunzione di grafite con il suffisso -ene, riferito al doppio legame della sostanza.
Sin dagli anni '50, Linus Pauling parlava nelle sue classi dell'esistenza di un sottile strato di carbonio, costituito da anelli esagonali. Philip Russell Wallace ha anche descritto alcune importanti proprietà di questa struttura anni prima.
Tuttavia, solo di recente, nel 2004, il grafene è stato isolato dai fisici Andre Geim e Konstantin Novoselov presso l'Università di Manchester e può essere profondamente conosciuto.
Stavano studiando la grafite e utilizzando la tecnica dell'esfoliazione meccanica sono riusciti a isolare uno strato di materiale utilizzando del nastro adesivo. Questo risultato ha assegnato il premio Nobel alla coppia nel 2010.
Importanza del grafene per il Brasile
Il Brasile possiede una delle maggiori riserve di grafite naturale, un materiale che contiene grafene. Le riserve naturali di grafite raggiungono il 45% del totale mondiale.
Sebbene la presenza di grafite sia osservata in tutto il territorio brasiliano, le riserve sfruttate si trovano a Minas Gerais, Ceará e Bahia.
Con abbondante materia prima, il Brasile investe anche nella ricerca sul territorio. Il primo laboratorio in America Latina dedicato alla ricerca con il grafene si trova in Brasile, presso l'Universidade Presbiteriana Mackenzie di San Paolo, chiamato MackGraphe.
Produzione di grafene
Il grafene può essere preparato da carburo, idrocarburo, nanotubi di carbonio e grafite. Quest'ultimo è il più utilizzato come materiale di partenza.
I principali metodi di produzione del grafene sono:
- Microesfoliazione meccanica: Un cristallo di grafite ha strati di grafene rimossi con un nastro, che vengono depositati su substrati contenenti ossido di silicio.
- Microesfoliazione chimica: i legami di carbonio vengono indeboliti dall'aggiunta di reagenti, rompendo parzialmente la rete.
- deposizione chimica da vapore: formazione di strati di grafene depositati su supporti solidi, come superficie di nichel metallico.
Prezzo del grafene
La difficoltà di sintetizzare il grafene su scala industriale fa sì che il valore di questo materiale sia ancora molto alto.
Rispetto alla grafite, il suo prezzo è migliaia di volte superiore. Mentre 1 kg di grafite si vende per 1 dollaro, la vendita di 150 g di grafene si fa per 15.000 dollari.
Curiosità sul grafene
- Progetto dell'Unione Europea, denominato Fiore all'occhiello del grafene, ha stanziato circa 1,3 miliardi di euro per la ricerca relativa al grafene, alle applicazioni e allo sviluppo produttivo su scala industriale. Circa 150 istituzioni in 23 paesi partecipano a questo progetto.
- La prima valigia sviluppata per i viaggi nello spazio ha il grafene nella sua composizione. Il suo lancio è previsto per il 2033, quando la NASA prevede di effettuare spedizioni su Marte.
- Il borofene è il nuovo concorrente del grafene. Questo materiale è stato scoperto nel 2015 ed è considerato una versione migliorata del grafene, essendo ancora più flessibile, resistente e conduttivo.
Grafene in Enem
Nel test Enem 2018, una delle domande di Scienze naturali e sue tecnologie riguardava il grafene. Controlla di seguito la risoluzione commentata di questo problema.
Il grafene è una forma allotropica del carbonio costituita da un foglio planare (array bidimensionale) di atomi di carbonio compattati dello spessore di un solo atomo. La sua struttura è esagonale, come mostrato in figura.
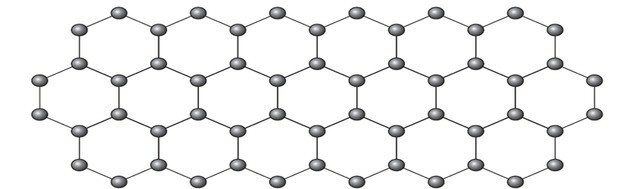
In questa disposizione, gli atomi di carbonio hanno ibridazione
a) sp della geometria lineare.
b) sp2 della geometria planare trigonale.
c) sp3 alternato a carboni sp-ibridati di geometria lineare.
d) sp3d della geometria piana.
e) sp3d2 con geometria planare esagonale.
alternativa corretta:b) sp2 della geometria planare trigonale.
L'allotropia del carbonio si verifica a causa della sua capacità di formare diverse sostanze semplici.
Poiché ha 4 elettroni nel guscio di valenza, il carbonio è tetravalente, cioè tende a formare 4 legami covalenti. Questi legami possono essere singoli, doppi o tripli.
A seconda dei legami che il carbonio crea, la struttura spaziale della molecola cambia nella disposizione che meglio accoglie gli atomi.
L'ibridazione si verifica quando c'è una combinazione di orbitali e per il carbonio può essere: sp, sp2 e sp3, a seconda del tipo di chiamate.
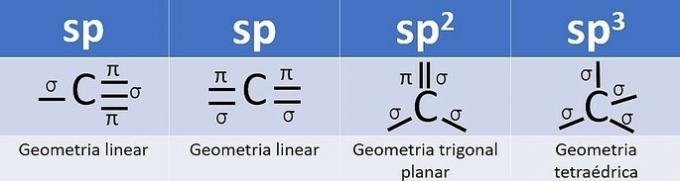
Il numero di orbitali ibridi è la somma dei legami sigma (σ) che il carbonio forma, poiché il legame non si ibrida.
- sp: 2 collegamenti sigma
- sp2: 3 collegamenti sigma
- sp3: 4 collegamenti sigma
La rappresentazione del grafene allotropo in palline e bastoncini, come mostrato nella figura in domanda, non dimostra i veri legami della sostanza.
Ma se osserviamo una parte dell'immagine, vediamo che c'è un carbonio, che rappresenta una palla, che si connette ad altri tre atomi di carbonio formando una struttura come un triangolo.
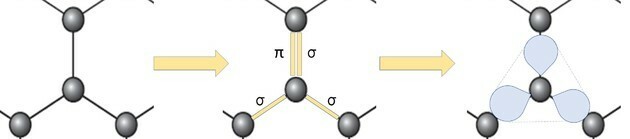
Se il carbonio ha bisogno di 4 legami ed è legato ad altri 3 atomi di carbonio, allora uno di quei legami è doppio.
Poiché ha un doppio e due singoli legami, il grafene ha ibridazione sp2 e, di conseguenza, geometria planare trigonale.
Le altre forme allotropiche note del carbonio sono: grafite, diamante, fullerene e nanotubo. Sebbene siano tutti fatti di carbonio, gli allotropi hanno proprietà diverse, derivanti dalle loro diverse strutture.
Leggi anche tu: Chimica a Enem e Domande di chimica in Enem.


