oh detersivo in polvere è un prodotto per la pulizia che fa parte della vita quotidiana di una larga fetta della popolazione, in quanto viene utilizzato per facilitare il lavaggio dei vestiti delle persone. È un prodotto che ha sostituito il sapone da bar, poiché, nel processo di lavaggio in generale, le persone avevano l'abitudine di strofinarlo sui vestiti.

La saponetta è ancora ampiamente utilizzata nel lavaggio dei piatti, ad esempio
Il sapone in polvere è stato prodotto per la prima volta nel 1946, dopo alcuni tentativi per rendere più facile l'uso del sapone da barra. Uno dei tentativi è stato quello di fabbricare il sapone in scaglie o granuli. Tuttavia, questi tentativi non hanno avuto successo perché il sapone interagisce con gli ioni presenti nell'acqua dura, compromettendo principalmente l'azione pulente.
Perché non possiamo chiamare così il detersivo per il bucato?
Chimicamente parlando, non possiamo chiamare così il detersivo per bucato. Se osserviamo la confezione di questi prodotti, vedremo che dice lavatrici, non detersivo. È corretto chiamarlo
Detersivo in polvere, poiché la sua composizione chimica è diversa dalla composizione di un sapone.La chimica del detersivo, o meglio, del detersivo, si basa sulla differenza fondamentale tra un sapone e un detersivo. Vedere la definizione e le caratteristiche chimiche di questi materiali:
a) Detergenti:
Sono sostanze chimiche che hanno catene molto lunghe (grande quantità di carbonio) costituita solo da atomi di carbonio e idrogeno, configurando quelle che chiamiamo regioni non polare. Inoltre, alla fine di questa lunga catena, c'è un gruppo polare.
La parte polare del detersivo è dovuta alla presenza di un gruppo solfonato, cioè un atomo di zolfo che interagisce con tre atomi di ossigeno, o un gruppo fosfato, che ha un atomo di fosforo che interagisce con tre atomi di ossigeno. Vedi la rappresentazione della struttura di un detersivo:
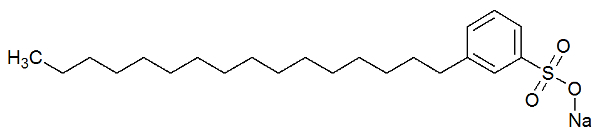
Formula strutturale di un detergente
La parte polare (formata da solfonato di sodio) del detersivo è in grado di interagire con le molecole d'acqua. La parte non polare (formata solo da atomi di carbonio e idrogeno) interagisce con le molecole di grasso. Così, il detersivo fa interagire il grasso con l'acqua e forma un'emulsione.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
b) Saponi
sono sali di acidi carbossilici originato dalla reazione chimica tra grassi e basi forti, come NaOH. Vedi la rappresentazione della struttura chimica del sapone:
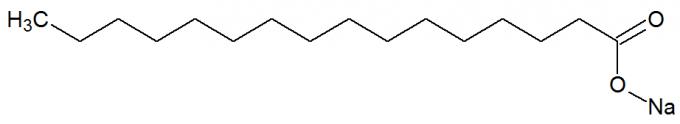
Formula strutturale di un sapone
Hanno anche lunghe catene di carbonio con una parte non polare e polare. In questo modo la parte apolare (costituita solo da atomi di carbonio e idrogeno) del sapone è in grado di interagire con grassi, e la sua parte polare (costituita dal gruppo COONa), con l'acqua, forma emulsioni, come i detersivi.
Poiché il focus di questo testo è la chimica della polvere di "sapone", ovvero la composizione chimica del detersivo in polvere, presentiamo tutte le sostanze chimiche che fanno parte della sua composizione, nonché l'importanza di ognuna di esse:
Composizione chimica del detersivo in polvere
tensioattivo anionico (come sodio alchilbenzensolfonato e sodio alchil etere solfonato). Si legano alla molecola del grasso così come alla molecola dell'acqua, rimuovendo così il grasso dal tessuto;
Enzimi: Lipasi e proteasi vengono utilizzate per aiutare a rimuovere le macchie. Questo perché, chimicamente, gli enzimi sono catalizzatori biochimici che promuovono la trasformazione di molecole complesse in molecole più semplici. Pertanto, le molecole più piccole possono essere rimosse più facilmente dagli indumenti;
Candeggina (perborato di sodio): Agisce per ossidazione, riduzione o azione enzimatica. In acqua, produce perossido di idrogeno, che è un potente agente ossidante. Reagiscono chimicamente con il pigmento del capo, modificandone la struttura e determinando un viraggio di colore;
Bloccanti ottici: sono sostanze che assorbono la radiazione ultravioletta o la luce ultravioletta e, poco dopo, emettono una luce fluorescente blu, mascherando, ad esempio, il colore giallastro degli indumenti;
Fragranze: Sono essenze utilizzate per lasciare un gradevole odore sui vestiti dopo il lavaggio. È interessante notare che le fragranze sono essenze (appartengono alla funzione estere);
coloranti: Sostanze utilizzate per colorare il prodotto;
Agenti sequestranti e chelanti: EDTA (acido etilendiamminotetraacetico) è un esempio di sequestrante. Interagiscono con gli ioni calcio, magnesio e ferro presenti principalmente nelle acque dure, non permettendo l'interazione di alcun componente ad azione pulente, come il tensioattivo.
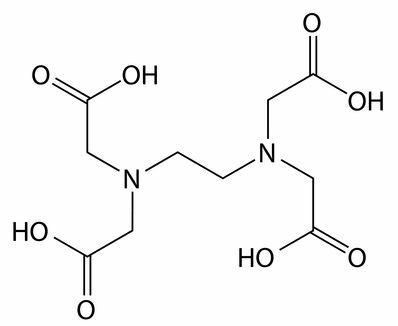
Formula di struttura del sequestrante EDTA
Di Me. Diogo Lopes Dias
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
GIORNI, Diogo Lopes. "Chimica del sapone in polvere"; Scuola Brasile. Disponibile in: https://brasilescola.uol.com.br/quimica/quimica-sabao-po.htm. Consultato il 28 giugno 2021.

