La termodinamica è un'area della fisica che studia i trasferimenti di energia. Cerca di comprendere le relazioni tra calore, energia e lavoro, analizzando le quantità di calore scambiate e il lavoro svolto in un processo fisico.
La scienza termodinamica è stata inizialmente sviluppata da ricercatori che cercavano un modo per migliorare le macchine, nel periodo della Rivoluzione Industriale, migliorandone l'efficienza.
Questa conoscenza è attualmente applicata in varie situazioni della nostra vita quotidiana. Ad esempio: macchine termiche e frigoriferi, motori per auto e processi per la trasformazione di minerali e prodotti petroliferi.
Leggi della Termodinamica
Le leggi fondamentali della termodinamica governano come il calore diventa lavoro e viceversa.
Prima Legge della Termodinamica
IL Prima Legge della Termodinamica si riferisce al principio di conservazione dell'energia. Ciò significa che l'energia in un sistema non può essere distrutta o creata, ma solo trasformata.
La formula che rappresenta la prima legge della termodinamica è la seguente:

La quantità di calore, lavoro e variazione di energia interna hanno come unità di misura standard il Joule (J).
Un esempio pratico di risparmio energetico è quando una persona usa una pompa per gonfiare un oggetto gonfiabile, usa la forza per pompare aria nell'oggetto. Ciò significa che l'energia cinetica fa abbassare il pistone. Tuttavia, parte di questa energia viene trasformata in calore, che viene disperso nell'ambiente.
IL Legge di Hess è un caso particolare del principio di conservazione dell'energia. Saperne di più!
Seconda Legge della Termodinamica
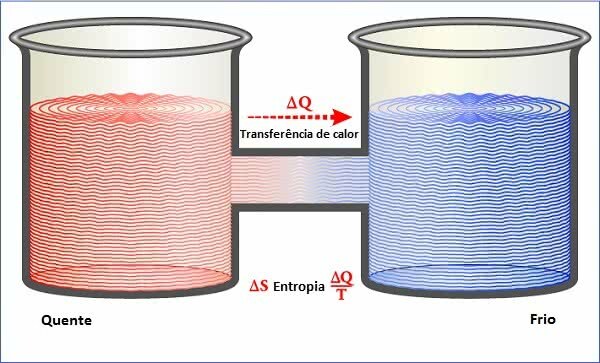
A trasferimenti di calore si verificano sempre dal corpo più caldo al corpo più freddo, avviene spontaneamente, ma non viceversa. Vale a dire che i processi di trasferimento di energia termica sono irreversibili.
In questo modo, dal Seconda Legge della Termodinamica, non è possibile convertire completamente il calore in un'altra forma di energia. Per questo motivo il calore è considerato una forma di energia degradata.

La grandezza fisica relativa alla Seconda Legge della Termodinamica è la entropia, che corrisponde al grado di disordine di un sistema.
Leggi anche:
- Ciclo di Carnot
- Dilatazione termica
Legge zero della termodinamica
IL Legge zero della termodinamica si occupa delle condizioni per ottenere il equilibrio termico. Tra queste condizioni possiamo citare l'influenza dei materiali che aumentano o diminuiscono la conducibilità termica.
Secondo questa legge,
- se un corpo A è in equilibrio termico a contatto con un corpo B e
- se questo corpo A è in equilibrio termico a contatto con un corpo C, allora
- B è in equilibrio termico a contatto con C.
Quando due corpi con temperature diverse vengono messi in contatto, quello più caldo cede calore a quello più freddo. Questo fa sì che le temperature si uniformino raggiungendo il equilibrio termico.
Si chiama legge zero perché la sua comprensione si è rivelata necessaria per le prime due leggi che già esistevano, la prima e la seconda legge della termodinamica.
Terza Legge della Termodinamica
IL Terza Legge della Termodinamica appare come un tentativo di stabilire un punto di riferimento assoluto che determini l'entropia. L'entropia è in realtà la base della Seconda Legge della Termodinamica.
Walther Nernst, il fisico che lo propose, concluse che non era possibile per una sostanza pura con una temperatura pari a zero avere entropia a un valore approssimativo di zero.
Per questo motivo è una legge controversa, considerata da molti fisici come una regola e non una legge.
sistemi termodinamici
In un sistema termodinamico possono esserci uno o più corpi correlati. L'ambiente che lo circonda e l'Universo rappresentano l'ambiente esterno al sistema. Il sistema può essere definito come: aperto, chiuso o isolato.
 sistemi termodinamici
sistemi termodinamici
Quando il sistema è aperto, c'è un trasferimento di massa ed energia tra il sistema e l'ambiente esterno. Nel sistema chiuso c'è solo trasferimento di energia (calore), e quando è isolato non c'è scambio.
comportamento dei gas
Il comportamento microscopico dei gas è più facilmente descritto e interpretato che in altri stati fisici (liquido e solido). Ecco perché i gas sono i più utilizzati in questi studi.
Negli studi termodinamici vengono utilizzati gas ideali o perfetti. È un modello in cui le particelle si muovono caoticamente e interagiscono solo nelle collisioni. Inoltre, si ritiene che questi urti tra le particelle, e tra queste e le pareti del contenitore, siano elastici e durino per un tempo molto breve.
In un sistema chiuso, il gas ideale assume un comportamento che coinvolge le seguenti grandezze fisiche: pressione, volume e temperatura. Queste variabili definiscono lo stato termodinamico di un gas.
 Comportamento dei gas secondo le leggi sui gas
Comportamento dei gas secondo le leggi sui gas
La pressione (p) è prodotta dal movimento delle particelle di gas all'interno del contenitore. Lo spazio occupato dal gas all'interno del contenitore è il volume (v). E la temperatura (t) è correlata all'energia cinetica media delle particelle di gas in movimento.
Leggi anche tu Legge sui gas e Studio dei Gas.
Energia interna
L'energia interna di un sistema è una grandezza fisica che aiuta a misurare come avvengono le trasformazioni che subisce un gas. Questa grandezza è correlata alla variazione della temperatura e dell'energia cinetica delle particelle.
Un gas ideale, composto da un solo tipo di atomo, ha energia interna direttamente proporzionale alla temperatura del gas. Questo è rappresentato dalla seguente formula:

Esercizi risolti di Termodinamica
domanda 1
Un cilindro con un pistone mobile contiene un gas a una pressione di 4.0.104N/m2. Quando vengono forniti al sistema 6 kJ di calore, a pressione costante, il volume del gas si espande di 1.0.10-1m3. Determinare il lavoro svolto e il cambiamento di energia interna in questa situazione.
Risposta corretta: il lavoro svolto è 4000 J e la variazione di energia interna è 2000 J.
Dati:
P = 4,0.104 N/m2
Q = 6KJ o 6000J
V = 1,0.10-1 m3
T =? U = ?
1° Passo: Calcola il lavoro con i dati del problema.
T = P V
T = 4.0.104. 1,0.10-1
T = 4000 J
2° passo: Calcolare la variazione dell'energia interna con i nuovi dati.
Q = T + ΔU
U = Q - T
U = 6000 - 4000
U = 2000J
Pertanto, il lavoro svolto è 4000 J e la variazione di energia interna è 2000 J.
Domanda 2
(Adattato da ENEM 2011) Un motore può svolgere lavoro solo se riceve una quantità di energia da un altro sistema. In questo caso, l'energia immagazzinata nel combustibile viene, in parte, ceduta durante la combustione affinché l'apparecchio possa funzionare. Quando il motore è in funzione, parte dell'energia convertita o trasformata nella combustione non può essere utilizzata per svolgere il lavoro. Ciò significa che c'è una perdita di energia in un'altra forma.
Secondo il testo, le trasformazioni energetiche che avvengono durante il funzionamento del motore sono dovute a:
a) Non è possibile rilasciare calore all'interno del motore.
b) il lavoro svolto dal motore è incontrollabile.
c) la conversione completa del calore in lavoro è impossibile.
d) la trasformazione dell'energia termica in cinetica è impossibile.
e) il potenziale utilizzo energetico del combustibile è incontrollabile.
Alternativa corretta: c) la conversione completa del calore in lavoro è impossibile.
Come visto in precedenza, il calore non può essere completamente convertito in lavoro. Durante il funzionamento del motore parte dell'energia termica viene persa, venendo ceduta all'ambiente esterno.
Vedi anche: Esercizi di Termodinamica