Le reazioni di ossidoriduzione studiate principalmente in Chimica Fisica sono quelle in cui avviene il trasferimento di elettroni. La specie che reagisce (atomo, ione o molecola) che perde uno o più elettroni è quella che subisce l'ossidazione. La specie chimica che riceve gli elettroni, invece, è ridotta.
Generalmente, quando questo tipo di reazione viene studiato in Chimica Inorganica, viene chiamato semplice reazione di scambio o di spostamento.
Perché qualsiasi reazione abbia luogo è necessario soddisfare determinate condizioni. Uno di questi è che ci deve essere affinità chimica tra i reagenti, cioè devono interagire in modo tale da consentire la formazione di nuove sostanze.
Nel caso delle reazioni redox, per affinità si intende che uno dei reagenti tende ad acquistare elettroni e l'altro tende a perderne. Questa tendenza corrisponde a reattività degli elementi chimici coinvolti.
Vediamo come è possibile confrontare la reattività tra i metalli.
Supponiamo di voler immagazzinare una soluzione di solfato di rame II (CuSO
4). Non potremmo assolutamente mettere questa soluzione in un contenitore di alluminio, perché si verificherebbe la seguente reazione:2 Al(S) + 3 CuSO4(ac)→ 3 Cu(S) + Al2(SOLO4)3(ac)
Nota che l'alluminio si è ossidato, perdendo 3 elettroni ciascuno e diventando catione di alluminio:
Al(S) → Al3+(Qui) + 3 e-
Contemporaneamente, il catione rame (Cu2+) che era presente nella soluzione riceveva elettroni dall'alluminio e si riduceva, diventando rame metallico. Ogni catione di rame riceve due elettroni:
Culo2+(Qui) + 2 e- → Cu(S)
Tuttavia, se fosse il contrario e volessimo conservare una soluzione di solfato di alluminio (Al2(SOLO4)3(ac)), non sarebbe un problema metterlo in un contenitore di rame, poiché questa reazione non si verificherebbe:
Culo(S) + Al2(SOLO4)3(ac) → non si verifica
Questi fatti osservati possono essere spiegati dal fatto che l'alluminio è più reattivo del rame.
I metalli hanno la tendenza a cedere elettroni, cioè ad ossidarsi. Quando si confrontano vari metalli, quello con la maggiore tendenza a donare elettroni è il più reattivo. Di conseguenza, la reattività dei metalli è anche associata alla loro energia ionizzata, cioè l'energia minima necessaria per rimuovere un elettrone dall'atomo gassoso nel suo stato fondamentale.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)

Sulla base di questo, il coda di reattività del metallo o fila di tensioni elettrolitiche, mostrato di seguito:
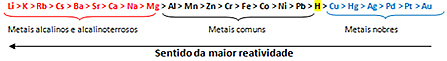
Il metallo più reattivo reagisce con sostanze ioniche i cui cationi sono meno reattivi. In altre parole, il metallo a sinistra reagisce con la sostanza formata dagli ioni alla sua destra. Non accade il contrario.
Ricordando l'esempio dato, vedere nella riga di reattività che l'alluminio (Al) è a sinistra del rame (Cu). Pertanto, l'alluminio reagisce con la soluzione formata da cationi di rame; ma il rame non reagisce con una soluzione formata da cationi di alluminio.
Si noti che il metallo più reattivo è il litio (Li) e il meno reattivo è l'oro (Au).

Questo è uno dei motivi per cui l'oro è così prezioso, perché se non reagisce rimane intatto per molto tempo. Lo si può vedere nei sarcofagi egizi e nelle sculture rivestiti d'oro che risalgono all'antichità più remota. Visualizziamo questo anche quando confrontiamo la durata di un gioiello in oro puro con gioielli realizzati con altri metalli che sono più reattivi dell'oro.

di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Ordine di reattività dei metalli"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/ordem-reatividade-dos-metais.htm. Consultato il 28 giugno 2021.


