Può capitare che ci siano acidi dello stesso elemento, e questo elemento abbia lo stesso numero di ossidazione (NOX), ma la differenza sta nei gradi di idratazione.
Ad esempio, di seguito, abbiamo tre acidi formati dall'elemento fosforo (P):
H3POLVERE4 H4P2oh7 HPO3
Si noti che in tutti e tre gli acidi il numero di ossidazione del fosforo è +5; la differenza sta nel grado di idratazione.
In base a ciò, questi acidi vengono differenziati nella nomenclatura tramite i prefissi orto, piro e meta.
L'acido più idratato si chiama orto. Nell'esempio dato, il primo (H3POLVERE4) è chiamato acido ortofosforico, perché è il più idratato dei tre. Il prefisso orto è sacrificabile, quindi la maggior parte delle volte questo acido verrà chiamato semplicemente acido fosforico.
I prefissi pyro e meta sono usati con ortoacido come punto di riferimento:
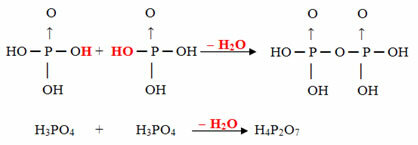
- Pyrus: 2 molecole di orto meno 1 molecola di H2oh
Esempio: H4P2oh7 è chiamato acido pirofosforico perché è uguale a due molecole di acido ortofosforico (H3POLVERE4) meno una molecola d'acqua.
2. H3POLVERE4 =H6P2oh8
H6P2oh8 - H2O = H4P2oh7
Questo processo è un disidratazione intermolecolare:
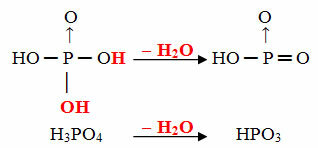
- Obiettivo: 1 molecola di orto meno 1 molecola di H2oh
Esempio: HPO3 è chiamato acido obbiettivofosforico perché è uguale a una molecola di acido ortofosforico (H3POLVERE4) meno una molecola d'acqua.
H3POLVERE4 - H2O = HPO3
Questo processo è un disidratazione intramolecolare:
di Jennifer Fogaça
Laureato in Chimica
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/grau-hidratacao-dos-acidos.htm

