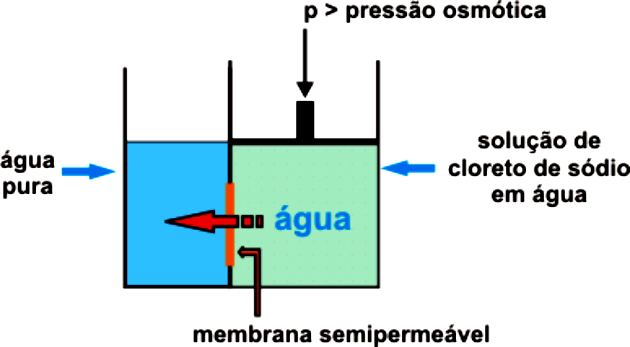
IL pressione osmotica è una proprietà colligativa che corrisponde alla pressione che deve essere esercitata su un sistema per evitare che l'osmosi si verifichi spontaneamente.
L'osmosi è il passaggio dell'acqua da un mezzo meno concentrato (ipotonico) ad uno più concentrato (ipertonico) attraverso una membrana semipermeabile fino al raggiungimento dell'equilibrio.
Per evitare che l'osmosi si attivi e avvenga naturalmente, è necessario applicare una pressione esterna sulla soluzione più concentrata, impedendo il passaggio del solvente al mezzo più concentrato. Questa è la pressione osmotica.
Più la soluzione è concentrata, maggiore dovrebbe essere la pressione osmotica. Pertanto, la pressione osmotica è proporzionale alla concentrazione di soluto.
Come calcolare la pressione osmotica?
Ogni soluzione ha un diverso valore di pressione osmotica. La pressione osmotica può essere calcolata dalla seguente formula:
= M. UN. t. io
Dove abbiamo le seguenti variabili:
π = pressione osmotica;
M = concentrazione in mol/L;
R = costante universale dei gas, il cui valore corrisponde a 0,082 atm. l. mole-1. K-1 o 62,3 mm Hg L. mole-1. K-1;
T = temperatura sulla scala assoluta (Kelvin);
i = fattore di Van't Hoff, che comprende la relazione tra il numero totale di particelle finali e iniziali nelle soluzioni ioniche.
Esercizio risolto
1. (Puccamp-SP) Occasionalmente, la soluzione di glucosio 0,30 M viene utilizzata in un'iniezione endovenosa, poiché ha una pressione osmotica vicina a quella del sangue. Qual è la pressione osmotica, in atmosfere, di detta soluzione a 37°C?
a) 1.00.
b) 1,50.
c) 1.76.
d) 7.63.
e) 9.83.
Considerando i dati forniti dalla domanda, abbiamo:
M = 0,30 mol/L;
R = 0,082 atm. l. mol-1. K-1
T = 37° + 273 = 310 K
Ora devi applicare questi valori alla formula per il calcolo della pressione osmotica:
= M. UN. t. io
π = 0,30. 0,082. 310
= 7,63 atm (Alternativa)
Classificazione delle soluzioni
Le soluzioni possono essere classificate in tre tipologie, in base alla pressione osmotica:
- soluzione ipertonica: Ha una pressione osmotica e una concentrazione di soluti più elevate.
- soluzione isotonica: Quando le soluzioni hanno la stessa pressione osmotica.
- soluzione ipotonica: Ha una pressione osmotica e una concentrazione di soluti inferiori.

L'importanza della pressione osmotica per gli esseri viventi
La soluzione salina è una sostanza preparata in base ai principi della pressione osmotica. Va applicato ad una pressione osmotica pari a quella riscontrata nel corpo, questo impedisce il Globuli rossi non soffrire di emolisi o avvizzire.
La pressione osmotica del sangue è di circa 7,8 atm. Pertanto, per il corretto funzionamento dell'organismo, i globuli rossi devono avere la stessa pressione osmotica, garantendo il normale flusso di acqua dentro e fuori le cellule.
Nei casi di disidratazione, ad esempio, è indicato l'uso di una soluzione salina, che deve essere isotonica rispetto alle cellule del sangue e agli altri fluidi corporei.
La soluzione salina ha la funzione di restituire l'equilibrio osmotico all'interno dell'organismo. Questo perché durante la disidratazione, il sangue diventa più concentrato rispetto all'interno delle cellule, facendole appassire.
Osmosi e osmosi inversa
Come abbiamo visto, il osmosi è il processo di passaggio dell'acqua dall'ambiente ipotonico a quello ipertonico, attraverso una membrana semipermeabile, fino al raggiungimento dell'equilibrio tra le concentrazioni.
Nel frattempo, il osmosi inversa è un processo di separazione delle sostanze attraverso una membrana che trattiene il soluto. Il solvente fluisce dal mezzo più concentrato a quello meno concentrato ed è isolato dal soluto da una membrana che ne permette il passaggio.
Questo avviene solo per la pressione esercitata, facendo sì che la membrana semipermeabile permetta solo il passaggio dell'acqua, trattenendo il soluto. Questa pressione deve essere maggiore della pressione osmotica naturale.
Ad esempio, se la pressione osmotica applicata è maggiore del necessario, si verificherà l'osmosi inversa. Pertanto, il flusso passerà dal mezzo con la concentrazione più alta a quello con la concentrazione più bassa.


