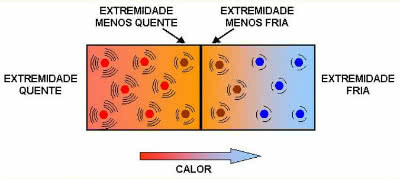
Il calore specifico (c) è una grandezza fisica che è correlata alla quantità di calore che produce una variazione termica, essendo una caratteristica di ciascun materiale.
In questo modo determina la quantità di calore necessaria per la variazione di 1°C di 1g della sostanza.
Tabella calore specifico
Ricorda che ogni sostanza ha un calore specifico. Controlla di seguito una tabella con 15 sostanze e i valori di calore specifico di ciascuna.
| Sostanza | Calore Specifico (cal/g.ºC) |
|---|---|
| acqua | 1 cal/g.°C |
| Alcol etilico | 0,58 cal/g°C |
| Alluminio | 0,22 cal/g°C |
| Aria | 0,24 cal/g°C |
| Sabbia | 0,2 cal/g°C |
| Carbonio | 0,12 cal/g.°C |
| Condurre | 0,03 cal/g.°C |
| Rame | 0,09 cal/g°C |
| Ferro | 0,11 cal/g°C |
| Ghiaccio | 0,50 cal/g°C |
| Idrogeno | 3,4 cal/g°C |
| legna | 0,42 cal/g°C |
| Azoto | 0,25 cal/g°C |
| Ossigeno | 0,22 cal/g°C |
| Bicchiere | 0,16 cal/g°C |
Secondo i dati della tabella, l'acqua ha un calore specifico di 1 cal/g.ºC. Ciò significa che l'energia di 1 lime è necessaria per una variazione di 1 °C in 1 g di acqua.
Formula del calore specifico
Per calcolare il calore specifico delle sostanze, viene utilizzata la seguente formula:
c = Q/m. T o c = C/m
Dove,
ç: calore specifico (cal/g°C o J/Kg. K)
Q: quantità di calore (calce o J)
m: massa (g o kg)
T: variazione di temperatura (°C o K)
Ç: capacità termica (cal/°C o J/K)
Nel Sistema Internazionale (SI), il calore specifico è misurato in J/Kg. K (Joule per chilogrammo e per Kelvin). Tuttavia, è molto comune essere misurati in cal/g°C (calorie per grammo e per grado Celsius).
1 cal = 4,186 J
Calore molare specifico
Il calore specifico molare, detto anche capacità termica molare, è determinato dal rapporto tra la capacità termica e il numero di moli presenti.
Quindi, quando la capacità termica di una sostanza viene data a una mole di quella sostanza, si parla di calore specifico molare.
Calore specifico e capacità termica
Un altro concetto legato al calore specifico è quello di capacità termica (Ç).
Questa grandezza fisica è determinata dalla quantità di calore fornita a un corpo e dalla variazione di temperatura subita da esso.
Può essere calcolato con la seguente formula:
C = Q/ΔT
Dove,
Ç: capacità termica (cal/°C o J/K)
Q: quantità di calore (calce o J)
T: variazione di temperatura (°C o K)
Esempio: se un corpo riceve 100 cal e la sua temperatura varia di 25°C, la sua capacità termica è di 4 cal/°C perché
C = Q/ΔT
C = 100 cal / 25 °C
C = 4 cal/°C
Ciò significa che per variare di 1°C dalla sua temperatura, il corpo ha bisogno di ricevere 4 cal.
Capacità termica e calore specifico sono legati attraverso la formula:
c = C/m
Dove,
Ç: capacità termica (cal/°C o J/K)
m: massa (g o kg)
ç: calore specifico (cal/g°C o J/Kg. K)
Se nell'esempio usato sopra il corpo ha una massa di 10 grammi, allora il suo calore specifico è 0,4 cal/g.ºC, perché
c = C/m
c = 4 cal/°C / 10 g
c = 0,4 cal/g.°C
Pertanto, 1 grammo della sostanza necessita di 0,4 cal per variare di 1 °C dalla sua temperatura.
Calore latente e calore sensibile
Oltre al calore specifico, esistono altre forme di calore, tra le quali spiccano:
Calore latente (L): corrisponde alla quantità di calore ricevuta o ceduta da un corpo. In questo caso, la tua temperatura rimane la stessa mentre cambia il tuo stato fisico.
Nel Sistema Internazionale (SI), il calore latente viene misurato in J/Kg (Joule per chilogrammo), tuttavia può essere misurato in cal/g (calorie per grammo). Si calcola con la seguente formula:
Q = m. l
Dove,
Q: quantità di calore (calce o J)
m: massa (g o kg)
l: calore latente (cal/g o J/Kg)
Nota: A differenza del calore specifico, il latente non dipende dalla temperatura. Questo perché quando si verificano cambiamenti di stato, la temperatura non varia. Ad esempio, un cubetto di ghiaccio che si scioglie, la temperatura dell'acqua allo stato solido e liquido è la stessa.
Calore sensibile: corrisponde alla variazione di temperatura di un corpo, ad esempio, quando riscaldiamo una barra di metallo. In questo esperimento, la temperatura del metallo aumenta, tuttavia, il suo stato fisico (solido) non cambia.
Si calcola con la seguente formula:
Q = m. ç. Δθ
Q: quantità di calore sensibile (calce o J)
m: massa corporea (g o kg)
ç: calore specifico della sostanza (cal/g°C o J/Kg°C)
Δθ: variazione di temperatura (°C o K)
Leggi anche su: calorimetria
Esercizi per l'esame di ammissione con feedback
domanda 1
(Mackenzie) In una mattina di cielo azzurro, un bagnante sulla spiaggia osserva che la sabbia è molto calda e l'acqua del mare è molto fredda. Di notte, questo stesso bagnante osserva che la sabbia della spiaggia è soffice e l'acqua del mare è calda. Il fenomeno osservato è dovuto al fatto che:
a) la densità dell'acqua di mare è inferiore a quella della sabbia.
b) il calore specifico della sabbia è inferiore al calore specifico dell'acqua.
c) il coefficiente di dilatazione termica dell'acqua è maggiore del coefficiente di dilatazione termica della sabbia.
d) il calore contenuto nella sabbia, di notte, si diffonde all'acqua di mare.
e) l'agitazione dell'acqua di mare ne rallenta il raffreddamento.
Alternativa corretta: b) il calore specifico della sabbia è inferiore al calore specifico dell'acqua.
Il valore del calore specifico dipende dalla sostanza che compone il corpo. In questo caso l'acqua ha un calore specifico più elevato della sabbia e, quindi, è necessaria una quantità di calore maggiore per variare la temperatura di 1 grammo di acqua rispetto a 1 grammo di sabbia.
Domanda 2
(UFPR) Per riscaldare 500 g di una certa sostanza da 20°C a 70°C erano necessarie 4000 calorie. La capacità termica e il calore specifico sono rispettivamente:
a) 8 cal/°C e 0,08 cal/g.°C
b) 80 cal/°C e 0,16 cal/g. °C
c) 90 cal/°C e 0,09 cal/g. °C
d) 95 cal/°C e 0,15 cal/g. °C
e) 120 cal/ºC e 0,12 cal/g. °C
Alternativa corretta: b) 80 cal/ºC e 0,16 cal/g. °C
La capacità termica è calcolata utilizzando la formula C = Q/Δθ ed è correlata matematicamente al calore specifico da C = m.c
Sostituendo i dati dell'istruzione nelle formule, abbiamo:
Domanda 3
(UFU) 240 g di acqua (calore specifico pari a 1 cal/g°C) vengono riscaldati assorbendo 200 W di potenza sotto forma di calore. Considerando 1 cal = 4 J, l'intervallo di tempo necessario perché questa quantità d'acqua vari la sua temperatura di 50 °C sarà?
a) 1 minuto
b) 3 minuti
c) 2 minuti
d) 4 minuti
Alternativa corretta: d) 4 min
1° passo: calcolare la quantità di calore
Passaggio 2: convertire le calorie in Joule
1 cal - 4 J
12000 cal - x
x = 12000 cal. 4 J/1 cal
x = 48 000 J
3° passo: calcolare la potenza
P = lavoro/tempo
200 W = 48 000 J/tempo
tempo = 48 000 J/200 W
tempo = 240 s
Passaggio 4: convertire i secondi in minuti
60 s - 1 min
240 s - y
y = 240 s. 1 min/60 s
y = 4 min
Leggi anche:
- Calore e temperatura
- diffusione del calore
- Bilancio termico