Soluto e solvente sono i due componenti di una miscela omogenea chiamata soluzione chimica.
- Soluto: è la sostanza che si disperde nel solvente. Corrisponde alla sostanza che verrà disciolta e, generalmente, si presenta in quantità minore nella soluzione.
- Solvente: è la sostanza in cui il soluto verrà sciolto per formare un nuovo prodotto. Si presenta in maggiore quantità nella soluzione.
La dissoluzione tra il soluto (disperso) e il solvente (disperdente) avviene attraverso interazioni tra le loro molecole.
La differenza tra questi due componenti di una soluzione è che il soluto è la sostanza che si dissolverà e il solvente è la sostanza che effettuerà la dissoluzione.
Il solvente più conosciuto è l'acqua, considerata la solvente universale. Questo perché ha la capacità di dissolvere una grande quantità di sostanze.
Solventi ed esempi di solventi
Guarda alcuni esempi di soluzioni chimiche e scopri i soluti e i solventi di ognuna di esse:
Acqua e sale
- Soluto: Sale da cucina - Cloruro di sodio (NaCl)
- Solvente: Acqua
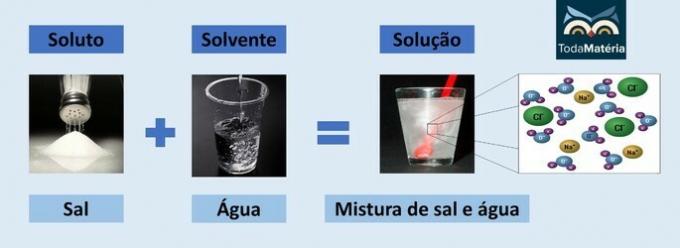
Essendo un composto ionico, il cloruro di sodio in soluzione si dissocia e forma ioni che, a loro volta, vengono solvatati da molecole di acqua.
Il polo positivo dell'acqua (H+) interagisce con l'anione del sale (Cl-) e il polo negativo dell'acqua (O2-) interagisce con il catione (Na+).
Questo è un tipo di soluzione elettrolitica, poiché le specie ioniche in soluzione sono in grado di condurre una corrente elettrica.
acqua e zucchero
- Soluto: Zucchero - Saccarosio (C12H22oh11)
- Solvente: Acqua

Lo zucchero è un composto covalente e quando sciolto in acqua il molecole si disperdono ma non cambiano identità.
Questa soluzione acquosa è classificata come non elettrolitica, in quanto il soluto disperso nella soluzione è neutro e, quindi, non reagisce con l'acqua.
Aceto
- Soluto: acido acetico (CH3COOH)
- Solvente: Acqua

L'aceto è una soluzione che contiene almeno il 4% di acido acetico, a acido carbossilico che, essendo polare, interagisce con l'acqua, anch'essa polare, tramite legami a idrogeno.
Una regola importante per la solubilità è che il simile dissolve il simile. I composti polari vengono disciolti in solventi polari, mentre le sostanze non polari si dissolvono in solventi non polari.
Altre soluzioni
Oltre alle soluzioni liquide, esistono anche soluzioni gassose e solide.
L'aria che respiriamo è un esempio di una soluzione gassosa, i cui gas in maggiore quantità sono azoto (78%) e ossigeno (21%).
A leghe metalliche sono soluzioni solide. Ad esempio, l'ottone (zinco e rame) è una miscela utilizzata per realizzare strumenti musicali.
Vuoi acquisire maggiori conoscenze? Quindi leggi questi altri testi:
- Soluzioni chimiche
- forze intermolecolari
- Miscele omogenee ed eterogenee
Cos'è il coefficiente di solubilità?
Il coefficiente di solubilità è il limite di soluto aggiunto al solvente a una data temperatura per formare una soluzione satura.
oh coefficiente di solubilità varia a seconda delle condizioni, e può aumentare o diminuire al variare della temperatura e del soluto in questione.
C'è un limite al quale il solvente può effettuare la dissoluzione.
Esempio: Se metti lo zucchero in un bicchiere d'acqua, al primo momento, noterai che lo zucchero scompare nell'acqua.
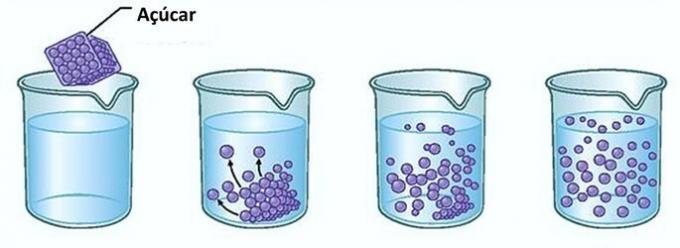
Tuttavia, se continui ad aggiungere zucchero, scoprirai che a un certo punto inizierà ad accumularsi sul fondo del bicchiere.
Questo perché l'acqua, che è il solvente, ha raggiunto il suo limite di solubilità e la massima concentrazione. Il soluto che rimane sul fondo del recipiente e non si dissolve si chiama corpo di sfondo.
Lo zucchero in eccesso sul fondo del bicchiere non si dissolverà e non influenzerà la concentrazione della soluzione. Inoltre, lo zucchero depositato sul fondo del bicchiere non renderà l'acqua più dolce.
Classificazione delle soluzioni
Le soluzioni possono essere classificate in base alla quantità di soluto disciolto. Pertanto, possono essere di tre tipi: saturi, insaturi e sovrasaturati.
- soluzione satura: La soluzione ha raggiunto il limite del coefficiente di solubilità, cioè c'è una quantità massima di soluto disciolto nel solvente ad una certa temperatura.
- soluzione insatura: La quantità di soluto disciolto non ha ancora raggiunto il coefficiente di solubilità. Ciò significa che è possibile aggiungere più soluto.
- soluzione supersatura: C'è più soluto disciolto che in condizioni normali. In questo caso presentano un precipitato.
Per saperne di più sulle soluzioni, leggi i seguenti testi.:
- Diluizione delle soluzioni
- molalità
- molarità
- Titolazione
Concentrazione di soluzioni
Dal soluto e dal solvente è possibile calcolare la concentrazione di una soluzione.
La concentrazione comune è definita come il rapporto tra la massa di soluto disciolto in un dato volume di soluzione.
Il calcolo della concentrazione viene effettuato utilizzando la seguente formula:
Essere,
Ç: Concentrazione (g/L);
m: massa di soluto (g);
V: volume della soluzione (L).
Esempio:
(Faap) Calcolare la concentrazione, in g/L, di una soluzione acquosa di nitrato di sodio contenente 30 g di sale in 400 mL di soluzione:
Risoluzione:
Osservare le informazioni relative alle quantità di soluto e solvente. Ci sono 30 g di sale (soluto) in 400 mL di soluzione acquosa (solvente).
Tuttavia, il volume è in mL e dobbiamo trasformarlo in L:
Ora, per conoscere la concentrazione, devi solo applicare la formula:
Con questo risultato siamo giunti alla conclusione che quando mescoliamo 30 g di sale con 400 ml di acqua, otterremo una soluzione con una concentrazione di 75 g/L.
Per ulteriori informazioni su come calcolare la concentrazione comune, questi testi saranno utili.:
- Concentrazione della soluzione
- Esercizi sulla concentrazione comune



