Quando si mescolano due soluzioni, diverse o meno, è necessario prima analizzare se c'è o meno una reazione tra di loro. Ad esempio, se mescoliamo una soluzione di acqua con zucchero (soluzione acquosa di saccarosio) con una soluzione di acqua con sale (salamoia), otterremo un miscelazione di soluzioni senza reazioni chimiche.
Lo stesso accade se mescoliamo due soluzioni di cloruro di sodio (NaCl), con diverse concentrazioni. Anche in questo caso non ci sarà alcuna reazione. Possiamo quindi definire questo esempio come a miscelazione di soluzioni dello stesso soluto, senza alcuna reazione chimica, dove il primo esempio è a miscelazione di soluzioni di diversi soluti, senza reazione chimica.
In entrambi i casi, la composizione chimica dei componenti delle soluzioni non cambierà., tuttavia, alcuni aspetti quantitativi dovranno essere ricalcolati.
Per capire come potremmo determinare la concentrazione molare (Molarità) e la concentrazione comune di una miscela di soluzioni senza reazione, vediamo la risoluzione dei due casi citati:
1°) Miscela di soluzioni dello stesso soluto, senza il verificarsi di reazione chimica:

Immaginiamo di mescolare due soluzioni di cloruro di sodio, una con una concentrazione di 2,0 g/L in 60,0 ml di soluzione e l'altra con 2,5 g/L in 80 ml di volume della soluzione.
Poiché non si verifica alcuna reazione, sia la massa che il volume sono solo la somma delle masse e dei volumi iniziali:
m (soluzione) = m1 (NaCl) + m2 (NaCl)
m1 (NaCl) = v. Cm2 (NaCl) = v. Ç
m1 (NaCl) = 0,06 L. 2,0 g/l m2 (NaCl) = 0,08 L. 2,5 g/litro
m1 (NaCl) =0,1 gm2 (NaCl) =0,2 g
m (soluzione) = 0,1 g + 0,2 g
m (soluzione) =0,3 g
v (soluzione) = v1 (NaCl) + v2 (NaCl)
v (soluzione) = (60 + 80) mL
v (soluzione) =140 mL = 0,14 L
La concentrazione può quindi essere ottenuta utilizzando questi dati:
C (soluzione) = m (soluzione)
v (soluzione)
C (soluzione) = 0,3 g
0,14L
C (soluzione)≈ 2,14 g/l
2°) Miscela di soluzioni di diversi soluti, senza che si verifichino reazioni chimiche:
Prendiamo ad esempio la miscela tra 500 ml di una soluzione acquosa di saccarosio (C12H22oh11) che inizialmente aveva una concentrazione di 18,0 g/L, con 1 L di una soluzione salina (soluzione acquosa di cloruro di sodio – NaCl) con una concentrazione di 100,0 g/L.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Dopo la miscelazione, quale è diventata la molarità, la concentrazione comune, la massa e il volume della soluzione risultante dalla miscela?
Poiché non vi era alcuna reazione chimica, le masse di C12H22oh11 e NaCl rimangono invariati. E i valori di massa iniziali possono essere raggiunti con una semplice regola del tre usando le concentrazioni di reazione.
18,0 g 1 litro
m (C12H22O11) 0,5L
m (Do12H22oh11) = 9,0 g
m (NaCl) 100.0 g
La massa può essere ottenuta anche con la formula:
m = v. Ç
m (Do12H22oh11) = 0,5 litri. 18 g/l
m (Do12H22oh11) = 9,0 g
m (NaCl) = 1 litro. 100,0 g/l
m (NaCl) = 100,0 g
Quindi, la massa totale della soluzione è la somma delle due masse:
m (soluzione) = m (C12H22oh11) + m (NaCl)
m (soluzione) = 109,0 g
Il volume è semplicemente la somma dei volumi iniziali, quindi abbiamo:
v (soluzione finale) = v (C12H22oh11) + v (NaCl)
v (soluzione finale) = (0,5 + 1)L
v (soluzione finale) = 1.5L
La concentrazione finale si ottiene calcolando separatamente le concentrazioni di ciascuno dei soluti. Poiché non reagiscono tra loro e le loro masse non cambiano, possiamo usare la seguente formula di concentrazione:
C = m
v
iniziale = miniziale finale c = mFinale
viniziale vFinale
miniziale = mFinale
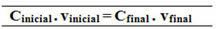
C (Do12H22oh11) =?
Çiniziale. viniziale = CFinale. vFinale
18,0 g/litro. 0,5 L = CFinale .1.5 L
C (Do12H22oh11) Finale = 6,0 g/L
C(NaCl)=?
Çiniziale. viniziale = CFinale. vFinale
100,0 g/litro. 1 L = Cfinale .1.5 L
C (NaCl)Finale = 66,67 g/l
La relazione fatta per questa formula della concentrazione comune può essere fatta anche per calcolare la molarità (Mio. vio = Mf. vf) e per la concentrazione in massa per massa (Titolo - Tio. vio = Tf. vf).
di Jennifer Fogaça
Laureato in Chimica

