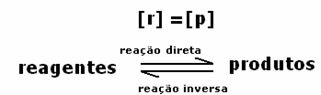
L'equilibrio dinamico o l'equilibrio chimico di una reazione si verifica quando le reazioni diretta e inversa si verificano contemporaneamente. Questi cosiddetti sistemi reversibili sono rappresentati da frecce in entrambe le direzioni:  o
o  . Un esempio di reazione reversibile è citato nell'immagine sopra, tra gas iodio e gas idrogeno.
. Un esempio di reazione reversibile è citato nell'immagine sopra, tra gas iodio e gas idrogeno.
All'inizio della reazione, la quantità di reagenti è massima e quella di prodotti è zero. Tuttavia, i reagenti reagiscono tra loro, diminuendo la loro concentrazione e aumentando quella dei prodotti formati. Anche la velocità di sviluppo della reazione diretta sta diminuendo.
All'aumentare della concentrazione dei prodotti, inizia la reazione inversa e si formano nuovamente i reagenti; aumenta anche la velocità di sviluppo della reazione inversa.
Al raggiungimento dell'equilibrio chimico, a temperatura costante, le velocità di sviluppo delle reazioni diretta e inversa sono uguali.
Tuttidiretto = Tutto inverso
Le tariffe sono le stesse, ma le concentrazioni no. È improbabile che le concentrazioni di reagenti e prodotti siano le stesse. Solo in rari casi ciò si verifica. Nella maggior parte dei casi la concentrazione dei reagenti sarà superiore a quella dei prodotti o viceversa.
Quindi, abbiamo tre possibili modi per rappresentare graficamente i tassi di sviluppo di reazioni dirette e inverse, che mettono in relazione le concentrazioni di reagenti e prodotti oltre il tempo. Esaminiamo ogni caso:
1° caso: Uguali concentrazioni:
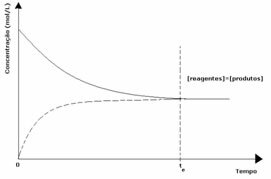
Come si vede nel grafico, al tempo te le reazioni diretta e inversa sono le stesse, nel qual caso le concentrazioni di reagenti e prodotti sono le stesse. Pertanto, l'equilibrio non viene spostato su entrambi i lati, l'intensità di entrambe le reazioni è la stessa, come espresso di seguito:
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
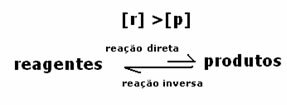
2° caso: Concentrazione dei reagenti maggiore della concentrazione dei prodotti:
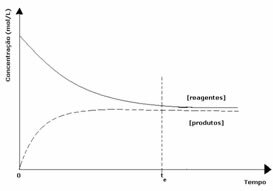
In questo caso si osserva che al raggiungimento dell'equilibrio la concentrazione dei reagenti è maggiore di quella dei prodotti. Quindi, si conclude che se c'è più reagente, la reazione inversa sta avvenendo con maggiore intensità. La reazione è spostata a sinistra:
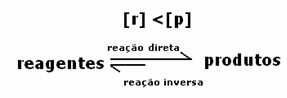
3° caso: Concentrazione dei prodotti superiore a quella dei reagenti:
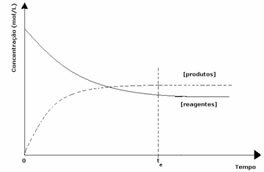
Poiché all'equilibrio la concentrazione dei prodotti è maggiore, ciò significa che la reazione è spostato a destra, perché la reazione diretta (con formazione di prodotti) avviene con maggiore intensità.
Ciò che indicherà se la reazione tende a destra oa sinistra sarà la costante di equilibrio K, che dipende solo dalla temperatura.
di Jennifer Fogaça
Laureato in Chimica
Squadra scolastica brasiliana
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Studio grafico dell'equilibrio chimico"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/estudo-grafico-equilibrio-quimico.htm. Consultato il 28 giugno 2021.
Chimica

Metti alla prova le tue conoscenze e impara di più con questo elenco di esercizi risolti sugli equilibri chimici. Attraverso questo materiale, sarai in grado di capire meglio come lavorare le costanti di equilibrio (Kp, Kc e Ki), lo spostamento dell'equilibrio, il pH e il pOH, nonché l'equilibrio nelle cosiddette soluzioni tampone.