La legge di Hess è stata creata dal chimico svizzero Germain H. Hess (1802-1850), considerato uno dei fondatori della Termochimica. La sua legge diceva:

Cioè, il ΔH dipende solo dai valori di entalpia dei reagenti e dei prodotti, come nell'espressione:
| H = ΔHreagenti + Hprodotti |
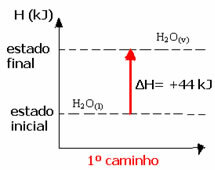
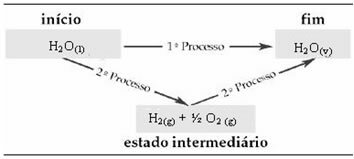
Ad esempio, si consideri la reazione in cui 1 mol di acqua (H2O) si trasforma in acqua allo stato gassoso. Questa reazione viene eseguita due volte; tuttavia, sono state scelte strade diverse:
(1°) Si è svolto in un unico passaggio:
H2oh(1) → H2oh(v) H= +44 kJ
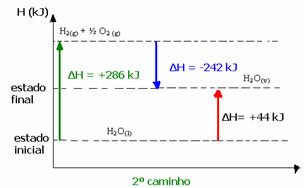
(2°) Si è svolto in due fasi:
1° passo: H2oh(1) → H2(g) + ½ il2 (g) H= +286 kJ
2° stadio: H2(g) + ½ il2 (g) → H2oh(v) H= -242 kJ
H2oh(1) → H2oh(v) H= +44 kJ
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Si noti che indipendentemente dal fatto che siano stati eseguiti uno o due passaggi, la variazione di entalpia (ΔH) è sempre di 44 kJ. Questo perché ΔH è la somma algebrica dei valori ΔH dei passaggi che compongono il processo, cioè i processi intermedi:
| H = ΔH1 + H2 + H3 + ... |
Ad esempio, nel secondo caso, il ΔH totale della reazione era la somma del ΔH del primo stadio (ΔH= +286 kJ) con quello del secondo (ΔH= -242 kJ). Quindi, abbiamo ottenuto lo stesso valore di reazione con un unico passaggio:
ΔH = (+286 + (-242)) kJ
H = (+286 -242) kJ
H = +44 kJ
Pertanto, siamo interessati solo ai valori iniziale e finale. In questo caso, lo stato iniziale corrisponde a H2oh(1) e la fine di H2oh(v).
Questa legge è diventata molto importante in Termochimica, perché alcune reazioni chimiche non possono avere il loro ΔH determinato sperimentalmente. Tuttavia, secondo la legge di Hess, l'entalpia di questo tipo di reazione può essere calcolata dalle entalpie di altre reazioni (reazioni intermedie).
di Jennifer Fogaça
Laureato in Chimica
Squadra scolastica brasiliana
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Legge di Hess"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/lei-hess.htm. Consultato il 28 giugno 2021.