IL elettronegatività è la tendenza di un atomo ad attirare verso di sé gli elettroni quando è legato ad un altro elemento chimico. attraverso un legame covalente, cioè in cui gli elettroni sono condivisi, considerando questa molecola come essere isolato.
Consideriamo due esempi per comprendere meglio il concetto presentato:
1° Esempio: Molecola di gas idrogeno: H2 → H - H
Quando due atomi di idrogeno si uniscono, si verificano contemporaneamente forze di attrazione tra il nucleo di ciascuno. uno di questi atomi dall'elettrone dell'altro atomo e forze di repulsione tra gli elettroni e i nuclei dei due atomi. Quando queste forze raggiungono l'equilibrio, i due elettroni si trovano in una regione delle elettrosfere che si trova da qualche parte tra i due. atomi della molecola, in cui entrambi interagiscono con i due elettroni, diventando stabili, cioè i due atomi condividono una coppia di elettroni.
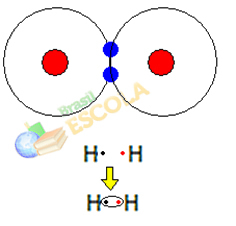
Questo è un legame covalente, che forma una molecola. Ma poiché i due atomi di questa molecola sono esattamente gli stessi, anche il modo in cui si attraggono gli elettroni è lo stesso. Quindi diciamo che
non c'è differenza di elettronegatività o che lei è apolare.2° Esempio: Molecola di cloruro di idrogeno: HC.
In questo caso la condivisione di una coppia di elettroni avviene tra elementi diversi, perché, a questo proposito, l'atomo di cloro attrae gli elettroni con maggiore intensità dell'idrogeno. Pertanto, diciamo che il cloro è più elettronegativo dell'idrogeno.
Come mostrato nella figura sottostante, a causa della differenza di elettronegatività, a dipolo elettrico (μ), che sono due monopoli elettrici, con gli elettroni che tendono ad essere più attratti dal cloro. Quindi il legame H ─ Cℓ avrà una parziale carica negativa sul cloro (δ-) e una parziale carica positiva sull'idrogeno (δ+). Quindi questa è una molecola con differenza di elettronegatività ed è polare:
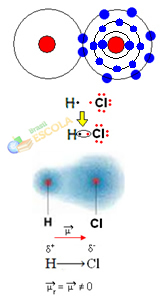
Questo ci mostra che l'elettronegatività è una quantità relativa, non assoluta, poiché è determinata tenendo conto dei confronti delle forze esercitate dagli atomi in un legame covalente.
Esistono diversi modi per calcolare l'elettronegatività, ma il più comune è la scala di elettronegatività proposta da Pauling. Diciamo di avere una molecola generica A ─ B. Pauling propose che l'energia di legame di questa molecola, simboleggiata da D, fosse data dalla somma della media aritmetica delle energie di legame (D) delle molecole di gas di questi due atomi, cioè A-A e B-B, con il quadrato della differenza di elettronegatività di ciascun atomo di quella molecola (XIL e xB):
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
D(A-B) = [D(AA) + D(B-B)]+k(xIL - XB)2
La costante k nella formula sopra è uguale a 96,5 kJ. mole-1. Pauling ha assegnato un valore arbitrario per l'elettronegatività dell'idrogeno, che era 2,1 e, in questo modo è stato possibile scoprire il valore di elettronegatività degli altri elementi in relazione a lui.
In base a questo metodo, sono stati dati i valori di elettronegatività di Pauling per gli elementi della Tavola Periodica, ad eccezione dei gas nobili.

Si noti che questi valori sono una proprietà periodica in quanto variano periodicamente in base ai numeri atomici degli elementi. Vedi, per esempio, che gli elementi più elettronegativi sono quelli nell'angolo in alto a destra della tabella, cioè il fluoro (4.0) e ossigeno (3.5), e i meno elettronegativi sono quelli nell'angolo in basso a sinistra, che sono francio (0.8) e cesio (0,8).
Sulla base di questo, è stata addirittura creata una riga di elettronegatività degli elementi più elettronegativi che tendono ad essere maggiormente lavorati:
F > O > N > Cℓ > Br > I > S > C > P > H
Vedi i valori di elettronegatività:
4,0 > 3,5 > 3,0 > 3,0 > 2,8 > 2,5 > 2,5 > 2,5 < 2,1
Esiste una sorta di "trucco" per decorare questa fila di elettronegatività, che è dato dalla frase sottostante, in cui l'iniziale di ogni parola corrisponde al simbolo degli elementi in questione:
“FCiao ohnon ho nooh Cltubo, fratelloho ottenuto ioSAhia Çsta morendo Pper il HOspedale"
Quindi possiamo dire che l'elettronegatività è una proprietà periodica che aumenta da sinistra a destra e dal basso verso l'alto sulla tavola periodica.

Ciò è dovuto alla dimensione del raggio atomico. Più grande è il raggio di un atomo, più lontani sono gli elettroni condivisi dal suo nucleo e, quindi, più debole è l'attrazione tra loro. È vero anche il contrario, più piccolo è il raggio atomico, più gli elettroni saranno vicini al nucleo e maggiore sarà l'attrazione tra di loro. Pertanto, possiamo concludere quanto segue:
L'elettronegatività aumenta al diminuire del raggio atomico.
di Jennifer Fogaça
Laureato in Chimica