A legami covalenti, chiamato anche legami molecolari o omopolari, sono quelli che si verificano tra gli atomi di elementi elettronegativi, cioè con tendenza a ricevere elettroni, stabilendo un legame di condividendo elettroni dai loro gusci di valenza.
Il legame covalente può verificarsi tra i seguenti elementi: idrogeno, non metalli e semimetalli. I metalli non partecipano mai a questo tipo di legame.
Consideriamo un semplice esempio di legame covalente: il legame a formazione di idrogeno (H2):
H + H → H2
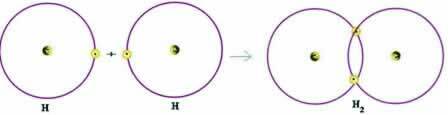
Si noti che entrambi gli atomi avevano bisogno di ricevere un elettrone per completare il loro guscio di valenza – secondo la regola dell'ottetto – e, in questo modo, rimanere stabili. Pertanto, condividevano i loro elettroni e, in questo modo, avevano entrambi due elettroni, avevano il loro guscio K completo e acquisivano la configurazione del gas nobile elio.
Questa condivisione di elettroni è ciò che differenzia questo tipo di legame dal legame ionico, in cui avviene il trasferimento di elettroni.
Vedere la figura seguente per altri due esempi di questo caso:
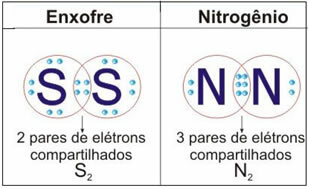
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
In questo tipo di legame si ha la formazione di molecole, che possono essere rappresentate dalle rispettive formule molecolari, cioè la rappresentazione più semplice che indica quanti atomi di ciascun elemento ci sono nella molecola. Alcuni esempi di formule molecolari sono: H2, S2, O2, no2, H2O, CO2, eccetera.
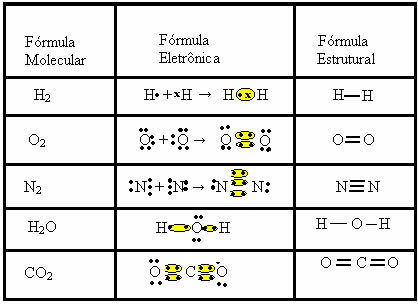
Il legame covalente può essere rappresentato da altre due formule:
- Formula elettronica o formula di Lewis: in questa formula compaiono anche gli elettroni del guscio di valenza di ogni atomo e la formazione delle coppie elettroniche. Questi elettroni sono simboleggiati dai segni . o x;
- Formula strutturale piatta o Formula strutturale coupé: mostra i collegamenti degli elementi, con ogni coppia condivisa corrispondente a un trattino. Se è solo un trattino lo chiamiamo collegamento singolo; se sono due, doppio legame; e se ci sono tre trattini, triplo legame.
Guarda altri esempi di legami covalenti rappresentati da queste tre formule chimiche:
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Legami covalenti"; Scuola Brasile. Disponibile in: https://brasilescola.uol.com.br/quimica/ligacoes-covalentes.htm. Consultato il 27 giugno 2021.

