A reazioni di combustione sono presenti in molti aspetti della nostra vita quotidiana. Ad esempio, le principali fonti di generazione di energia derivano dalla combustione o dalla combustione di determinati combustibili, come etanolo, benzina, carbone, tra gli altri. Inoltre, l'energia di cui abbiamo bisogno per sopravvivere e per lavorare è il risultato delle reazioni di combustione che avvengono all'interno delle nostre cellule quando “bruciamo” il cibo che mangiamo.
Ma cosa ci vuole per avere una reazione di combustione?
Servono tre cose:
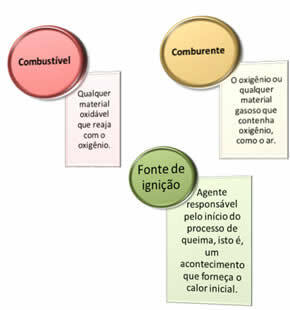
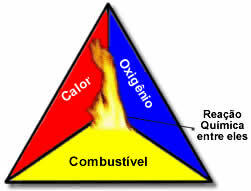
Questi tre fattori costituiscono il triangolo di fuoco, perché una volta iniziata la reazione di combustione, l'energia rilasciata sostiene la reazione e le consente di continuare fino a quando il combustibile, l'ossidante o il calore (energia rilasciata) sono esauriti. Ciò significa che ci sarà un Reazione a catena.
Ad esempio, se qualcuno lancia una sigaretta accesa in una foresta, ci sarà un incendio (reazione di combustione). In questo caso, il cespuglio
è il carburante, O ossigeno presente nell'aria atmosferico è il ossidante è il sigaretta acceso era il fonte di accensione. Questa combustione continuerà fino a quando uno dei tre fattori non sarà eliminato. Se i vigili del fuoco gettano acqua, il calore sarà eliminato. Ma anche se non si fa nulla per fermare questo incendio, a un certo punto finirà, cioè quando il combustibile (la foresta) si esaurirà.Come già accennato, in queste reazioni viene rilasciato calore, quindi la combustione è una reazione esotermica. Tuttavia, questo tipo di reazione è una combustione incompleta. Per capire perché, vedi la differenza tra combustione completa e incompleta:
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Combustione completa:
Analizzando i composti organici come combustibili, dobbiamo:
| IL combustione completa si verificherà quando la catena di carbonio è rotta e tutti gli atomi di carbonio nella catena di carbonio sono completamente ossidati. |
| voi prodotti formati dagli idrocarburi sarà il CO2 (anidride carbonica) e H2oh (Acqua). |
Osservare la combustione completa dell'isottano, che è uno dei componenti della benzina.
Ç8H18(g) +25/2 O2 (g) → 8 CO2(g) + 9 del mattino2oh(1)
Combustione incompleta
| In questo caso, non c'è abbastanza ossidante, cioè abbastanza ossigeno per bruciare tutto il carburante. |
| Quindi, i prodotti formati sono CO (monossido di carbonio) e H2oh. |
Osserva la stessa combustione di isottano, tuttavia, ora in modo incompleto:
Ç8H18(g) + 17/2 O2(g) → 8 CO (g) + 9 del mattino2oh(1)
L'incendio delle foreste ne è un esempio, in quanto le emissioni che ne derivano sono costituite da CO e da sostanze particolari, come fuliggine (C), oltre a ceneri e altri composti organici semplici e complessi. Ossido di azoto, ozono e aldeidi possono anche formarsi a seguito di reazioni secondarie dovute alla presenza di altri componenti nell'aria.
Ç8H18(g) + 9/2 O2 (g) → 8C (g) + 9 del mattino2oh(1)
di Jennifer Fogaça
Laureato in Chimica
Squadra scolastica brasiliana
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Combustione completa e incompleta"; Scuola Brasile. Disponibile in: https://brasilescola.uol.com.br/quimica/combustao-completa-incompleta.htm. Consultato il 27 giugno 2021.