
A volte può capitare formula minima essere la stessa della formula molecolare del composto; Tuttavia, questo non è sempre vero.
Ad esempio, la formula empirica o minima per l'acqua è H2O, indicando che esiste un rapporto 2:1 tra gli elementi che compongono le molecole d'acqua. E, guarda caso, questa è anche la formula molecolare dell'acqua. Tuttavia, per vedere che ciò non accade sempre, guarda i due esempi seguenti:
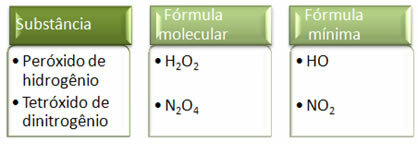
Poiché la formula minima è solo il rapporto tra gli atomi di ciascun elemento e non la quantità effettiva di essi nella formula molecolare, può verificarsi di diversi composti aventi la stessa formula empirica e anche la formula minima di un composto può essere la stessa della formula molecolare di altro. Nota, nell'esempio seguente, come ciò può accadere:
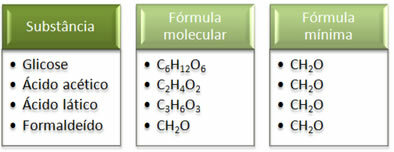
Vedi che la formula minima CH2La è la stessa per tutte le sostanze, cioè questa formula minima esprime che, in tutti i casi, la gli atomi di carbonio, idrogeno e ossigeno sono presenti nelle formule molecolari in un rapporto di 1:2:1. Inoltre, l'unica che ha la stessa formula molecolare della formula empirica è la formaldeide.
- Calcolo della formula minima o empirica:
Per determinare la formula empirica di un composto, è prima necessario sapere qual è la sua percentuale o formula prossima. Questo può essere fatto misurando la massa di ciascun elemento in 100 g di campione. Il testo "Formula percentuale o centesimale” chiarisce meglio la questione.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Ad esempio, supponiamo che la composizione prossima di un dato composto sia data da: 40,00% C, 6,67% H e 53,33% O. Passiamo questi valori ai grammi, considerando una massa di 100 g di campione di compost. Quindi abbiamo: 40 g di C, 6,67 g di H e 53,33 g di O.
Ora è necessario passare questi valori alla quantità di materia (mol). Lo facciamo dividendo ciascuno dei valori trovati per le rispettive masse molari:
C: 40/12 = 3.33
H: 6,67/1 = 6,67
O: 53,33/16 = 3,33
Poiché i valori non sono interi, utilizziamo il seguente dispositivo: dividiamo tutti i valori per il più piccolo di essi, in modo che la proporzione tra loro non venga modificata.
In questo caso, il valore più piccolo è 3,33, quindi il risultato sarà:
C: 3,33/3,33 = 1
H: 6,67/3,33 = 2
O: 3,33/3,33 = 1
Pertanto, la formula minima di questa sostanza sconosciuta è uguale a: Ç1H2oh1 o CH2oh.
In breve, i passaggi necessari per trovare la formula empirica o minima di una sostanza sono:

di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Formula minima o empirica"; Scuola Brasile. Disponibile in: https://brasilescola.uol.com.br/quimica/formula-minima-ou-empirica.htm. Consultato il 28 giugno 2021.


