Lorenzo Romano Amedeo Carlo Avogadro (1776-1856) è stato un chimico italiano che per primo stabilì l'idea che a campione di un elemento, con massa in grammi numericamente uguale alla sua massa atomica, ha sempre lo stesso numero di atomi (N).
Lo stesso Avogadro non è stato in grado di determinare il valore di N. Tuttavia, per tutto il ventesimo secolo, il progresso della tecnologia e della conoscenza scientifica ha permesso ad altri scienziati di sviluppare tecniche per determinarlo. Quando questo valore è stato finalmente scoperto, è stato chiamato La costante di Avogadro, in onore di questo scienziato, poiché fu lui a gettare le basi per la sua creazione.

Lorenzo Romano Amedeo Carlo Avogadro (1776-1856)
In 1 mole di qualsiasi entità (atomi, molecole, elettroni, formule o ioni) è contenuto esattamente il valore della costante di Avogadro.
La tabella seguente mostra alcuni valori per la costante di Avogadro ottenuti nel corso del XX secolo:
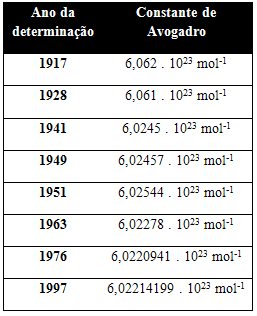
Ecco alcune delle tecniche utilizzate per cercare di determinare il valore della costante di Avogadro:
Il primo scienziato a fare un calcolo approssimativo per la costante di Avogadro fu Johann Joseph Loschmidt. Nell'anno 1867, si è basato sulla teoria cinetica dei gas e ha determinato quante molecole esistono in 1 cm3 di un gas.
Un altro di questi scienziati fu il francese Jean Baptiste Perrin (1870-1942) che contò il numero di particelle colloidali per unità di volume in una sospensione e ne misurò le masse. Il valore che ha trovato era compreso tra 6.5 e 7.2. 1023 entità per mol. Questo scienziato pubblicò, nel 1913, il libro Gli atomi (1a ed. Paris: Alcan), e la sua nona edizione, pubblicata nel 1924, conteneva 16 modi per ottenere sperimentalmente la costante di Avogadro.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)

Jean Baptiste Perrin (1870-1942)
Anni dopo, lo scienziato James Dewar (1842-1923) utilizzò un metodo sviluppato anni prima dal radiochimico Bertram Boltwood (1870-1927) e dal fisico Ernest Rutherford (1871-1937), che consisteva sostanzialmente nel contare le particelle alfa emesse da una sorgente radioattiva e nel determinare il volume di elio gassoso ottenuto. Il valore trovato da Dewar era 6,04. 1023 mole-1.
Nel XX secolo, Robert Millikan (1868-1953) effettuò un esperimento per determinare la carica dell'elettrone (1,6. 10-19 ). Poiché era già nota la carica di 1 mole di elettroni (96500 C), è stato possibile mettere in relazione questi due valori e trovare il seguente valore per la costante di Avogadro: 6,03. 1023 mole-1.
Attualmente, il valore consigliato per la costante di Avogadro è 6.02214 x 1023 mole-1 e si determina mediante diffrazione di raggi X, in cui si ottiene il volume di pochi atomi di un reticolo cristallino, purché si conosca la densità e la massa di 1 mole di atomi nel campione.
Ai fini della didattica, al Liceo, dove i calcoli non devono essere accurati come quelli eseguiti nei laboratori chimici, la costante di Avogadro è considerata come 6,02. 1023 mole-1.
Esistono anche metodi più semplici che possono essere utilizzati per aiutare gli studenti a determinare la costante di Avogadro nella pratica. Uno di questi è attraverso l'elettrolisi in un mezzo acquoso.
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Determinazione della costante di Avogadro"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/determinacao-constante-avogadro.htm. Consultato il 28 giugno 2021.


