Il chimico francese Joseph Louis Proust (1754-1826) procedette ad accurati esperimenti mettendo in relazione le masse dei componenti di certe reazioni.
Ad esempio, gli elementi che compongono l'acqua sono l'idrogeno e l'ossigeno. Proust scoprì che in questa reazione di formazione dell'acqua, l'idrogeno reagiva sempre con l'ossigeno in un rapporto costante e definito, che era rispettivamente di 1:8. Guarda come succede di seguito:

Notare che indipendentemente dalla massa di elementi utilizzati, la proporzione sarà sempre la stessa.
Proust ha notato che questo non era solo il caso dell'acqua, ma di tutte le altre sostanze.
15,06 g di solfuro rameico (CuS) si formano, ad esempio, facendo reagire 10.00 g di rame metallico (Cu) con 5,06 g di zolfo (S). Quindi, se raddoppiamo la quantità di rame (che andrà a 20,0 g), e se vogliamo che tutto il rame reagisca, sarà inoltre necessario raddoppiare la quantità di zolfo, a 10,12 g, con la formazione totale di 30,12 g di solfuro.
Ora, se viene aggiunto un importo non proporzionato, l'importo in eccesso rimarrà, non reagirà. Nota questo di seguito:
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
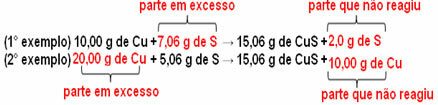
Notare che la reazione avviene solo secondo la proporzione definita. Pertanto, nel 1799, Proust concluse che, quando più sostanze si combinano per formare un composto, ciò avviene sempre in una relazione di massa definita.
Così creò una Legge che si chiama La legge di Proust, Legge delle proporzioni costanti o Legge delle proporzioni definite, che si afferma come segue:

Questa legge e la Legge di Lavoisier (Legge sulla conservazione della massa) sono nominati Leggi sul peso, perché parlano in massa di sostanze coinvolte.
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Legge di Proust o Legge delle Proporzioni Costanti"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/lei-proust-ou-lei-das-proporcoes-constantes.htm. Consultato il 27 giugno 2021.