Quando diciamo la parola “equilibrio”, viene in mente un oggetto che rimane indefinitamente. Tuttavia, questo è solo un tipo di equilibrio, chiamato "equilibrio statico".
C'è anche il "equilibrio dinamico". In esso, come dice il nome, non c'è un solo momento in cui l'oggetto o il fenomeno in questione sia fermo. Ad esempio, per farti capire, guarda l'illustrazione sotto e nota che la quantità di acqua che cade nel contenitore è uguale alla quantità che ne esce, mantenendo costante il livello dell'acqua. In tal caso, diciamo che c'è un equilibrio dinamico, un equilibrio in movimento.

È questo tipo di equilibrio che si verifica in reazioni reversibili, cioè in quelle reazioni che si verificano in entrambe le direzioni. Nello stesso momento in cui le molecole dei reagenti si trasformano nei prodotti, le molecole dei prodotti reagiscono tra loro per formare i reagenti. La reversibilità di una reazione è rappresentata da frecce in entrambe le direzioni:
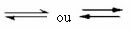
Nel momento in cui la velocità di sviluppo della reazione diretta (di formazione dei prodotti) è uguale alla velocità di sviluppo del reazione inversa (formazione di reagenti), a temperatura costante, significa che la reazione ha raggiunto il suo equilibrio chimico. E nel caso di reazioni con presenza di sole molecole nei reagenti e nei prodotti, abbiamo a equilibrio molecolare.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Quello che segue è un esempio della reazione che avviene tra il gas idrogeno (H2) e iodio gassoso (I2), per la formazione di acido iodidrico (HI) gas:
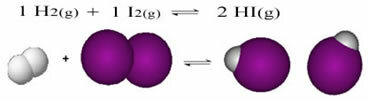
All'inizio della reazione, la velocità di sviluppo della reazione diretta era più alta, dopotutto la concentrazione dei reagenti era massima e quella dei prodotti era zero. Quindi anche la velocità di sviluppo della reazione inversa era zero.
Tuttavia, nel tempo, i gas idrogeno e iodio reagiscono, generando il prodotto. In questo modo la concentrazione dei reagenti inizia a diminuire e diminuisce anche la loro velocità di sviluppo.
All'aumentare della concentrazione dei prodotti e alla diminuzione della concentrazione dei reagenti, la velocità di sviluppo della reazione inversa inizia ad aumentare. Se la temperatura viene mantenuta costante, verrà un momento in cui le due velocità di sviluppo rimarranno le stesse, dimostrando così che la reazione ha raggiunto l'equilibrio chimico molecolare.
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Bilancio molecolare"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/equilibrio-molecular.htm. Consultato il 28 giugno 2021.


