Nel 1874, il chimico olandese Jacobus Henrique van't Hoff (1852-1911) e il chimico francese Joseph Achille le Bel (1847-1930), attraverso teorie matematiche, suggerì indipendentemente l'esistenza dei carboni asimmetrico.
All'epoca furono pesantemente criticati, in particolare van't Hoff, dal famoso chimico tedesco Adolph Wilhelm Kolbe (1818-1884). Kolbe però si sbagliava, oggi sappiamo che esiste un carbonio asimmetrico, tanto che, nel 1901, van't Hoff fu il primo chimico a ricevere il Premio Nobel.
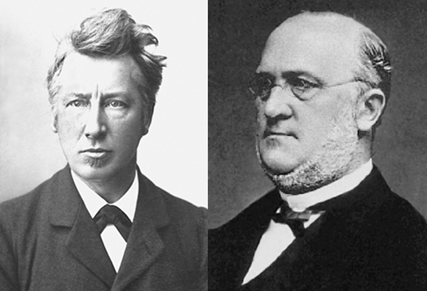
van't Hoff (a sinistra) e Kolbe (a destra)
Una delle condizioni necessarie affinché la molecola abbia attività ottica è che sia asimmetrica. Inoltre, un modo per verificare se è asimmetrico è studiarne la struttura in dettaglio per vedere se ha almeno un carbonio asimmetrico.
Cos'è una molecola asimmetrica e un carbonio asimmetrico?
Qualcosa di simmetrico è qualcosa che ha almeno un piano di simmetria. Ad esempio, se tagliamo a metà una racchetta da tennis, le due parti risultanti saranno esattamente le stesse. Inoltre, se li mettiamo davanti a uno specchio piatto, produrranno un'immagine identica.
Le strutture che non supportano un piano di simmetria sono chiamate asimmetrico. Un esempio è la nostra mano, perché se la mettiamo davanti a uno specchio, produrrà un'immagine diversa di se stessa. Se mettiamo la mano destra, l'immagine sarà la mano sinistra e viceversa. Un altro punto importante è che non si sovrappongono.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Ecco perché si chiama anche carbonio asimmetrico carbonio chirale, da dove ha origine questa parola khéir che in greco significa mano.
Un esempio di molecola asimmetrica è la talidomide, la cui struttura è mostrata di seguito:

Il punto con l'asterisco (*) corrisponde a un carbonio asimmetrico, in quanto ha quattro legami covalenti che sono fatti con diversi atomi o gruppi di atomi.
Sotto c'è un carbonio con quattro diversi ligandi davanti a uno specchio. Notare che l'immagine non può essere sovrapposta alla struttura originale:

Le due molecole ottenute sopra sono isomeri ottici o enantiomeri.
Tornando al caso della talidomide, per il fatto che ha carbonio asimmetrico, il risultato è che la molecola inizia ad avere un'immagine non sovrapponibile, che corrisponde ad un'altra sostanza. Quindi abbiamo due isomeri della talidomide con proprietà estremamente diverse.
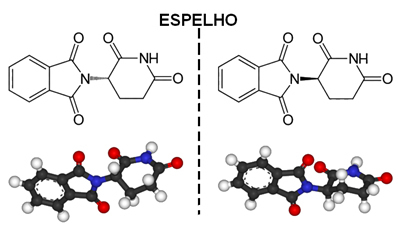
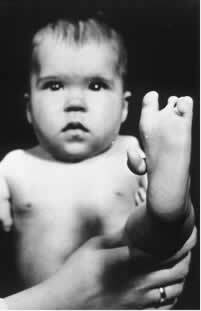
Uno di questi (R) isomeri ha proprietà sedative. Pertanto, alla fine degli anni '50, iniziò ad essere usato come tranquillante e aiuto per dormire per le donne incinte. Ciò ha innescato una tragedia, poiché anche i suoi enantiomeri (S) erano mescolati con il farmaco. Questo isomero, a sua volta, è teratogeno e ha portato molte donne incinte ad avere bambini con mani, gambe, braccia e piedi atrofizzati.
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Carbonio asimmetrico o chirale"; Scuola Brasile. Disponibile in: https://brasilescola.uol.com.br/quimica/carbono-assimetrico-ou-quiral.htm. Consultato il 27 giugno 2021.