Uno dei modi in cui sono organizzati gli elementi chimici è attraverso le famiglie, che corrispondono alle sequenze verticali della tavola periodica.
A 18 colonne della tabella raggruppare gli elementi secondo somiglianze nelle proprietà chimiche.
Organizzare gli elementi chimici in famiglie era un modo pratico per strutturare le varie informazioni trovate e presentarle in modo semplice.
Per facilitare la localizzazione di un elemento chimico, le famiglie sono state designate in numeri da 1 a 18 come mostrato di seguito:
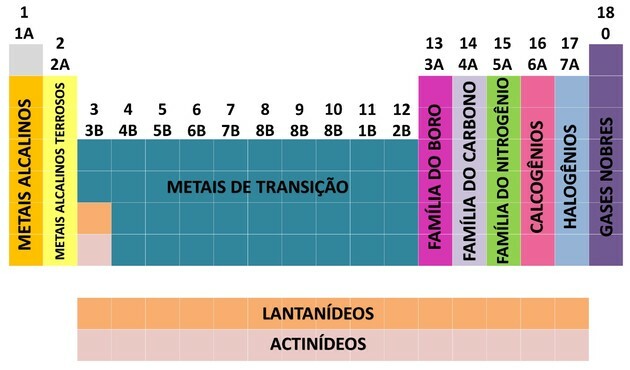
Attraverso il contributo di molti scienziati e vari tentativi di organizzare i dati, la tavola periodica si è evoluta, stabilendo un ordine per disporre gli elementi.
Nomenclatura delle famiglie
- Le famiglie nella tabella sono state divise in A (rappresentante) e B (transizione), essendo identificate da lettere e numeri.
- voi elementi rappresentativi le famiglie 0, 1A, 2A, 3A, 4A, 5A, 6A e 7A corrispondono.
- voi elementi di transizione le famiglie 1B, 2B, 3B, 4B, 5B, 6B, 7B e 8B corrispondono.
- Per determinazione dell'Unione Internazionale di Chimica Pura e Applicata (IUPAC), le famiglie sono state identificate in gruppi da 1 a 18.
Tavola periodica e distribuzione elettronica
Le somiglianze tra gli elementi della stessa famiglia si verificano perché il numero di elettroni di valenza dell'atomo nello stato fondamentale è lo stesso per i membri di un certo gruppo.
Per esempio:
| Gruppo 1 | Distribuzione elettronica |
|---|---|
| 3leggere | 2-1 |
| 11A | 2-8-1 |
| 19K | 2-8-8-1 |
| 37Rb | 2-8-18-8-1 |
| 55Cs | 2-8-18-18-8-1 |
| 87Fr | 2-8-18-32-18-8-1 |
Gli atomi del gruppo 1 hanno i loro elettroni distribuiti su più di un livello energetico, ma tutti hanno un elettrone di valenza.
Con ciò, osserviamo che facendo il distribuzione elettronica dell'atomo allo stato fondamentale, troviamo la sua posizione sulla tavola periodica.
elementi rappresentativi
Gli elementi rappresentativi mostrano un comportamento chimico relativamente meno complesso degli elementi di transizione e formano la maggior parte delle sostanze che ci circondano.
Ad alcune delle famiglie di elementi rappresentative vengono dati nomi speciali, come mostrato di seguito:
Gruppo |
Famiglia | nome specifico | Origine del nome | Elementi | configurazione elettronica |
|---|---|---|---|---|---|
| 1 | 1A | metalli alcalini | dal latino alcali, che significa “grigio di piante”. | Li, Na, K, Rb, Cs e Fr | noi1 |
| 2 | 2A | metalli alcalino-terrosi | Il termine "terreno" si riferisce a "esistente sulla terra". | Be, Mg, Ca, Sr, Ba e Ra | noi2 |
| 13 | 3A | famiglia boro | Nome del primo elemento della famiglia. | B, Al, Ga, In, Tl e Nh. | noi2np1 |
| 14 | 4A | famiglia del carbonio | Nome del primo elemento della famiglia. | C, Si, Ge, Sn, Pb e Fl. | noi2np2 |
| 15 | 5A | Famiglia dell'azoto | Nome del primo elemento della famiglia. | N, P, As, Sb, Bi e Mc. | noi2np3 |
| 16 | 6A | Calcogeni | dal greco khalk, in quanto sono elementi presenti nei minerali di rame. | O, S, Se, Te, Po e Lv. | noi2np4 |
| 17 | 7A | Alogeni | Espressione greca che significa formatori di sale. | F, Cl, Br, I, A e Ts. | noi2np5 |
| 18 | 0 | Gas nobili | Si è ritenuto che non reagisse con altre sostanze. | He, Ne, Ar, Kr, Xe, Re e Og. | 1s2 (Lui) o noi2np6 |
Attraverso la tabella possiamo vedere che:
- Gli elementi presentati sopra sono classificati come rappresentativi perché hanno l'elettrone più energetico in un sottolivello s o p.
- Gli elettroni sono distribuiti su livelli energetici e n rappresenta il livello più esterno dell'atomo nello stato fondamentale.
- Gli elementi rappresentativi, secondo la raccomandazione della IUPAC, appartengono ai gruppi o famiglie 1,2,13,14,15,16,17 e 18.
oh idrogeno è classificato separatamente dagli altri elementi. Anche con configurazione elettronica 1s1, non fa parte del gruppo 1 perché ha un comportamento singolare.
elementi di transizione
Gli elementi di transizione corrispondono ai gruppi da 3 a 12. Ricevono questo nome perché hanno caratteristiche intermedie tra i gruppi 1 e 2 e gli elementi non metallici rappresentativi.
voi metalli di transizione sono definiti da IUPAC come:
Un elemento di transizione ha un sottolivello d incompleto o può formare cationi con un sottolivello d incompleto.
Quando l'elettrone più energetico dell'atomo di stato fondamentale si trova in un sottolivello d incompleto, è caratterizzato come una transizione esterna.
Lantanidi e attinidi sono elementi di transizione interna in quanto hanno almeno un sottolivello f incompleto.
Quando gli elementi hanno elettroni che riempiono gli orbitali d o f, mostrano proprietà simili e possono essere classificati in elementi orbitali d o f. transizione esterna o interna.
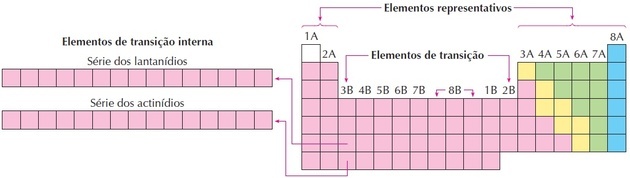
Come possiamo vedere nell'immagine, la famiglia 8B corrisponde a 3 colonne, sono i gruppi 8, 9 e 10, che sono stati raggruppati così perché hanno caratteristiche simili.
Principali caratteristiche delle famiglie
La tabella seguente mostra le principali proprietà dei gruppi nella tavola periodica:
| Gruppo | Caratteristiche | sostanze composte più comune |
occorrenze |
|---|---|---|---|
| 1 | Solido e brillante in condizioni ambientali. Conduttori di elettricità molto reattivi, morbidi e buoni. | Sali, idrossidi e ossidi |
Reagire con gli alogeni e formare sali. |
| 2 | Meno reattivo e più duro del gruppo 1. Solidi d'argento con buona conduttività. | Sali, idrossidi e ossidi |
Formazione di sali e ossidi. |
| da 3 a 12 | Formano complessi. Sono solidi metallici, duri e fragili, ad eccezione del mercurio, che è un liquido. | Sali, ossidi e complessi. Es: AgNO3, TiO e [Cr(OH)3(H2o)3] |
Nei minerali sotto forma di ossidi. |
| 13 | Solidi in condizioni ambientali, argento, ad eccezione del boro. | ossidi Es: B2oh3 |
Nei minerali sotto forma di ossidi. |
| 14 | Solido in condizioni ambientali. | Gli atomi di C e Si possono organizzarsi in catene e produrre un'enorme varietà di sostanze. | Negli organismi viventi e sotto forma di silicati o ossidi. |
| 15 | Solidi, ad eccezione dell'azoto, che è gassoso in condizioni ambientali. | Ossidi e acidi Es: NO2 e H3POLVERE4 |
Atmosfera, organismi viventi e minerali. |
| 16 | Solidi, ad eccezione dell'ossigeno, che è gassoso in condizioni ambientali. | Solfuri e ossidi Es: ZnS e SiO2 |
Atmosfera, organismi viventi e minerali. |
| 17 | Formano molecole biatomiche e sono molto reattive. Sono cattivi conduttori di elettricità e calore. Sono aggressivi per gli esseri viventi e l'ambiente. | Acidi e Sali. Es: HCl e KBr |
Sono presenti nelle sostanze organico e minerale. |
| 18 | Sono molto stabili e si trovano sotto forma di gas. | Difficilmente formano sostanze composte. | Gas nell'atmosfera. |
Le proprietà chimiche e fisiche distinguono una famiglia dall'altra. Come abbiamo visto, le proprietà chimiche sono legate a elettroni di valenzae attraverso di essi un atomo interagisce con un altro, essendo responsabile del comportamento chimico e legami chimici formato.
Le proprietà fisiche degli elementi nello stesso gruppo possono variare in base al numero atomico e alla massa.
Esercizi
Ora che sai qualcosa in più sulle famiglie della tavola periodica, metti alla prova le tue conoscenze e guarda cosa hai imparato.
1) Si consideri il seguente estratto della tavola periodica.
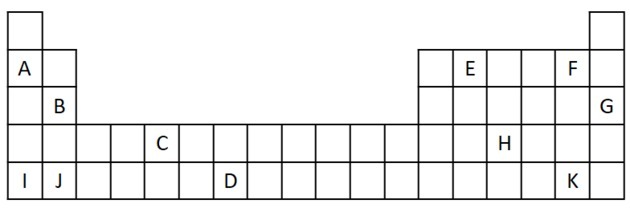
a) Nomina due elementi che hanno due elettroni di valenza.
b) Indicare un elemento che reagisce violentemente con l'acqua, producendo un idrossido metallico.
c) Indicare un elemento non reattivo.
d) Indicare due elementi che si combinano con metalli alcalini per formare sali.
Rispondere:
a) B e J
Due elettroni di valenza corrispondono al gruppo 2, che ha una configurazione elettronica ns2 e sono rappresentati nell'esercizio da B e J.
b) A, B, I o J.
A e I rappresentano elementi della famiglia 1; B e J provengono dalla famiglia 2. Come abbiamo visto nella tabella delle proprietà, gli elementi del gruppo 1 e 2 sono molto reattivi e possono formare idrossidi, come negli esempi forniti: KOH e Mg (OH)2.
c) G
I gas nobili sono molto stabili e quindi poco reattivi. La lettera G è inserita nella tabella come elemento di questa famiglia.
d) F e K
Gli alogeni reagiscono con i metalli alcalini per formare sali. L'esempio più comune di questo è il sale da cucina, NaCl.
2) La figura seguente mostra tre elementi chimici, da sinistra a destra, litio, sodio e potassio.

Seleziona l'opzione che completa correttamente ciascuna delle seguenti affermazioni.
1.1) "Possiamo dire che litio, sodio e potassio...
(A) … appartengono allo stesso periodo.”
(B) …ha lo stesso numero atomico.”
(C) … appartengono allo stesso gruppo.”
(D) …ha lo stesso numero di massa.”
1.2) "Gli elementi litio, sodio e potassio...
(A) …ha proprietà chimiche molto simili.”
(B) …ha proprietà chimiche molto diverse.”
(C) … sono non metalli.”
(D) … reagiscono con l'acqua per formare soluzioni acide.”
Risposte:
1.1) (C) appartengono allo stesso gruppo.
1.2) (A) ha proprietà chimiche molto simili.
Possiamo ottenere queste informazioni consultando la tavola periodica o effettuando la distribuzione elettronica degli elementi litio, sodio e potassio. Vedremo che i tre hanno un elettrone nel guscio di valenza e poiché fanno parte dello stesso gruppo, le proprietà chimiche sono molto simili.
3) Si consideri la seguente tabella, dove sono rappresentati i numeri atomici e le distribuzioni elettroniche di alcuni elementi chimici.
| Elemento | simbolo chimico | numero atomico | Distribuzione elettronica |
|---|---|---|---|
| Litio | leggere | 3 | 2,1 |
| Berillio | essere | 4 | 2,2 |
| Fluoro | F | 9 | 2,7 |
| neon | eh? | 10 | 2,8 |
| cloro | Cl | 17 | 2,8,7 |
| argon | Aria | 18 | 2,8,8 |
| Potassio | K | 19 | 2,8,8,1 |
| Calcio | Qui | 20 | 2,8,8,2 |
Indica il gruppo di ogni elemento.
Rispondere:
Litio e potassio: gruppo 1. (Hanno un elettrone nel guscio di valenza).
Berillio e calcio: gruppo 2. (Hanno due elettroni nel guscio di valenza).
Fluoro e cloro: gruppo 17. (Hanno sette elettroni nel guscio di valenza).
Neon e argon: gruppo 18. (Hanno otto elettroni nel guscio di valenza).
Controlla le domande dell'esame di ammissione con una risoluzione commentata in Esercizi sulla tavola periodica e domande inedite sull'argomento in Esercizi sull'organizzazione della tavola periodica.

