L'ebollizione è il passaggio da uno stato liquido a uno stato gassoso. Succede quando una porzione di liquido, sottoposta ad una data pressione, riceve calore e raggiunge una certa temperatura.
La quantità di calore che il corpo deve ricevere per trasformarsi completamente in vapore dipende dalla sostanza che lo costituisce.
Una sostanza allo stato liquido non ha una forma definita, assumendo la forma del contenitore che la contiene.
Essendo praticamente incomprensibile, presenta una forza coesiva tra le particelle che lo costituiscono.
Per passare allo stato gassoso, la sostanza deve ricevere calore. Questo aumento di energia farà vibrare le molecole con maggiore intensità, aumentando la distanza tra loro.
In questo modo la forza coesiva diventa praticamente inesistente. Il corpo in questo stato non ha forma o volume definiti.
I geyser sono esempi di ebollizione che si verifica con le acque sotterranee situate nelle regioni vulcaniche. Il magma riscalda l'acqua e quando raggiunge una certa temperatura inizia a cambiare stato.
Il vapore occupa un volume maggiore, aumentando la pressione nella cavità sotterranea. Di conseguenza, una miscela di vapore e liquido viene espulsa in superficie attraverso piccole crepe.

Caratteristiche di ebollizione
Un liquido bolle nel seguente schema:
- Mantenendo la pressione costante, la temperatura durante tutto il processo di ebollizione rimarrà costante.
- La quantità di calore per unità di massa necessaria affinché un liquido si trasformi completamente in vapore è chiamata calore latente di vaporizzazione. Il suo valore dipende dalla sostanza che compone il liquido.
- La temperatura alla quale ogni sostanza bolle è ben determinata ed è chiamata punto di ebollizione.
Mancia: Quando cuciniamo il cibo, è una buona idea abbassare il fuoco quando l'acqua inizia a bollire. Poiché la temperatura rimane costante durante tutto il processo di bollitura, il tempo di cottura sarà lo stesso sia a fuoco alto che a fuoco basso. In questo modo si risparmia gas e l'ambiente è grato.
Quantità di calore latente
La quantità di calore che un liquido deve ricevere per trasformarsi in vapore dipende dal valore del calore latente di vaporizzazione e dalla sua massa.
Di seguito presentiamo il valore del calore latente di vaporizzazione di alcune sostanze:

Formula
Per calcolare la quantità di calore necessaria affinché un liquido cambi stato, usiamo la seguente formula:
Dove,
Qv: quantità di calore (calce)
m: massa (g)
lv: calore latente di vaporizzazione (cal/g)
Esempio:
Quanto calore è necessario perché 100 g di Etanolo bolliscano e si trasformino completamente in vapore?
Qv = 100. 204 = 204 000 cal
Temperatura di ebollizione
La temperatura alla quale un corpo subisce l'ebollizione dipende dalla sostanza che lo compone e dalla pressione a cui è sottoposto.
Il punto di ebollizione delle sostanze viene determinato in laboratorio. Ad esempio, il punto di ebollizione dell'acqua, sottoposta a 1 atmosfera, è 100°C. Il ferro è 2800 °C, mentre l'idrogeno è - 252,8 °C.
Per conoscere la temperatura di cambiamento di fase di altre sostanze, leggi anche punto di ebollizione.
Minore è la pressione a cui è sottoposto un corpo, minore è il suo punto di ebollizione. Ciò significa che nelle città ad alta quota ci vuole molto più tempo per cucinare il cibo.
Per cucinare il cibo più velocemente, usiamo pentole a pressione. Questo tipo di cucina utilizza un sistema di tenuta che fa sì che la pressione al suo interno sia maggiore della pressione atmosferica.
La pressione più alta fa aumentare anche il punto di ebollizione. Nel caso dell'acqua, bollirà ad una temperatura che può raggiungere i 120 ºC, riducendo i tempi di cottura.
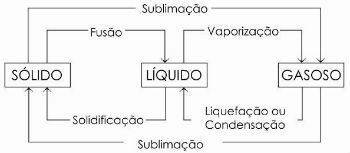
cambiamenti di fase
Il passaggio da uno stato liquido a uno stato gassoso è chiamato genericamente vaporizzazione, in quanto comprende, oltre alla bollitura, altri due processi: evaporazione e riscaldamento.
L'evaporazione avviene gradualmente, senza bisogno di raggiungere una temperatura specifica per verificarsi. D'altra parte, il riscaldamento si verifica quando poniamo il liquido su una superficie a una temperatura superiore al suo punto di ebollizione.
Ci sono ancora altri processi di cambiamento di stato. Sono loro:
- Fusione
- solidificazione
- Liquefazione o condensazione
- sublimazione
Nel diagramma sottostante rappresentiamo i tre stati fisici della materia e i rispettivi cambi di stato:
Per saperne di più leggi anche tu Stati fisici dell'acqua.
Esercizi
Enem - 1999
Il testo dovrebbe essere utilizzato per le seguenti due domande.
La pentola a pressione consente di cuocere i cibi in acqua molto più velocemente rispetto alle pentole convenzionali. Il suo coperchio ha una guarnizione in gomma che non lascia fuoriuscire il vapore, se non attraverso un foro centrale su cui poggia un peso che controlla la pressione. Quando è in uso, all'interno si accumula un'alta pressione. Per il suo funzionamento in sicurezza è necessario osservare la pulizia del foro centrale e l'esistenza di una valvola di sicurezza, normalmente posta nel coperchio.
Lo schema della pentola a pressione e un diagramma di fase dell'acqua sono presentati di seguito.
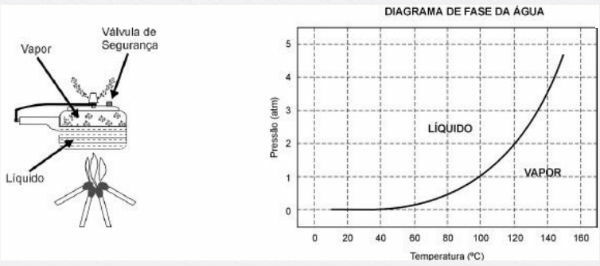
1) Il vantaggio di utilizzare una pentola a pressione è la velocità di cottura dei cibi e questo è dovuto a
a) la pressione al suo interno, che è uguale alla pressione all'esterno.
b) la temperatura del suo interno, che è al di sopra della temperatura di ebollizione dell'acqua del luogo.
c) la quantità di calore aggiuntivo che viene trasferita alla padella.
d) la quantità di vapore in uscita dalla valvola.
e) lo spessore della sua parete, che è maggiore di quello delle pentole comuni.
Alternativa b: alla sua temperatura interna, che è al di sopra della temperatura di ebollizione dell'acqua nel locale.
2) Se per economia abbassiamo il fuoco sotto la pentola a pressione non appena il vapore esce dalla valvola, semplicemente per mantenere il tempo di ebollizione, il tempo di cottura
a) sarà più grande perché la teglia si “raffredda”.
b) sarà più piccolo, in quanto riduce la perdita d'acqua.
c) sarà maggiore al diminuire della pressione.
d) sarà maggiore al diminuire dell'evaporazione.
e) non cambierà in quanto la temperatura non cambia.
Alternativa e: non verrà modificata in quanto la temperatura non varia.