Considera la generica reazione reversibile di seguito, dove le lettere minuscole corrispondono ai coefficienti di reazione bilanciata e le lettere maiuscole sono i reagenti e i prodotti sono tutti gassosi:

Considerando separatamente ciascuna delle direzioni di reazione, le loro velocità di sviluppo (Td) sono date da:
*Reazione diretta: aA + bB → cC + dD
Tuttidiretto = Kdiretto. [IL]Il. [B]B
*Reazione inversa: cC + dD → aA + bB
Tuttiinverso = Kinversione. [Ç]ç. [D]d
La costante di equilibrio chimico in termini di concentrazione in quantità di materia (Kç) e in termini di pressione parziale (KP) sarà dato dividendo Kdiretto di Kinversione.
Quindi abbiamo:
Kdiretto. [IL]Il. [B]B = 1 → Kdiretto__ = __[Ç]ç. [D]d___
Kinversione. [Ç]ç. [D]d Kinversione [IL]Il. [B]B
Essere, Kç =_Kdiretto_
Kinversione
Quindi abbiamo:
Kç =__[Ç]ç. [D]d___ o KP =__(Praca)ç. (pD)d___ |
Dove p è la pressione parziale di ciascuna sostanza all'equilibrio.
In questo modo ogni concentrazione viene innalzata ad un esponente corrispondente al coefficiente della rispettiva sostanza in reazione, e K
ç non ha unità*.Inoltre, un aspetto molto importante da evidenziare è che in questa espressionenon devono essere rappresentati né componenti solidi né liquidi puri., poiché solo le materie che possono subire variazioni partecipano a questa espressione. La concentrazione in quantità di materia di una sostanza allo stato solido è costante e quindi è già compresa nel valore di K stesso.ç. Lo stesso vale per i liquidi puri come l'acqua. In breve, solo le sostanze allo stato gassoso e in soluzione acquosa partecipano all'espressione.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Nota gli esempi seguenti:
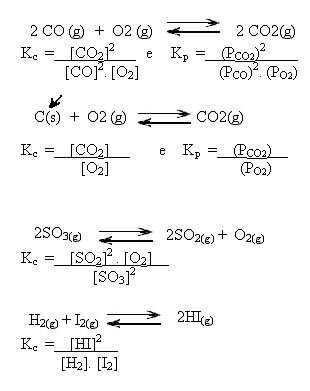
valori Kç può mostrarci se la concentrazione di reagenti e prodotti sono uguali o se uno è maggiore dell'altro:
- Se Kç o KP è uguale a uno (Kç = 1), ciò significa che la concentrazione di reagenti e prodotti è uguale;
- se il valore di Kç o KP essere alto, questo significa che i prodotti sono in maggiore concentrazione, perché nell'espressione di Kç i prodotti sono al numeratore;
- se il valore di Kç o KP è basso, questo significa che i reagenti sono in concentrazione maggiore, perché nell'espressione di Kç i reagenti sono al denominatore.
*Kç e KP sono numeri adimensionali, cioè numeri puri, senza unità relative a nessuna grandezza o relazione tra grandezze.
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Costanti di equilibrio Kc e Kp"; Scuola Brasile. Disponibile in: https://brasilescola.uol.com.br/quimica/constantes-equilibrio-kc-kp.htm. Consultato il 28 giugno 2021.


