*Teoria di Arrhenius:
Sulla base dei suoi esperimenti con conducibilità elettrica in mezzi acquosi, chimica, fisica e matematica Lo svedese Svante August Arrhenius (1859-1927) propose, nel 1884, i seguenti concetti per definire acidi e basi:

Quindi, genericamente, abbiamo:
H+ + H2O → H3oh+
Esempi:
HCl + H2O → H3oh++ Cl-
HNO3+ H2O → H3oh+ + NO3-
H2SOLO4+ 2H2O → 2H3oh+ + OS42-

Esempi:
NaOH → Na + + OH-
Ca(OH)2 →Ca2+ + 2 OH-
*Teoria di Brönsted-Lowry:
Indipendentemente, il danese Johannes Nicolaus Brönsted (1879-1947) e l'inglese Thomas Martin Lowry (1874-1936), propose nello stesso anno un'altra teoria acido-base nota come Teoria di Brönsted-Lowry, che dice A seguire:

In questo caso, lo ione idrogeno è considerato un protone. Questo si vede nella seguente reazione, dove l'acido cianidrico dona un protone all'acqua, che funge quindi da base:
HCN + H2O → CN- + H3oh+
Questa reazione è reversibile, con lo ione idronio (H3oh+) può donare un protone allo ione CN-. Così, lo ione idronio (H3oh+) agisce come un acido e il CN- come base.
CN- + H3oh+→ HCN + H2oh
*Teoria di Lewis:
Questa teoria è stata creata dal chimico americano Gilbert Newton Lewis (1875-1946) e afferma quanto segue:

Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Questa teoria introduce un nuovo concetto, è più completa, ma non invalida la teoria di Brönsted-Lowry. Per ogni acido di Lewis è un acido di Brönsted, e quindi ogni base di Lewis è una base di Brönsted. Questo perché un protone riceve elettroni, il che significa che un acido di Lewis può unire una coppia solitaria di elettroni in una base di Lewis.
Per Lewis, una reazione acido-base consiste nella formazione di un legame covalente coordinato più stabile. Quindi quando una base di Lewis dona una coppia di elettroni a una base di Lewis, entrambi formano a legame covalente coordinato, in cui entrambi gli elettroni provengono da uno degli atomi, come nell'esempio sotto:
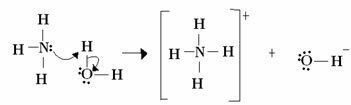
In questo caso, l'ammoniaca funge da base di Lewis e Brönsted, poiché cede i suoi due elettroni al protone ed è quindi il ricevitore del protone. Inoltre, si è formato un legame covalente tra l'idrogeno (il protone) e l'ammoniaca.
L'acqua è un acido di Lewis e Brönsted, poiché dona il protone e riceve gli elettroni, notate come l'ossigeno nell'idrossido formato dall'acqua abbia una coppia di elettroni in più.

di Jennifer Fogaça
Laureato in Chimica
Squadra scolastica brasiliana.
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Teorie acido-base di Arrhenius, Brönsted-Lowry e Lewis"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/teorias-acidobase-arrheniusbronstedlowry-lewis.htm. Consultato il 28 giugno 2021.