oh Modello atomico Thomson fu proposto nell'anno 1898 dal fisico inglese Joseph John Thomson o, semplicemente, J.J. Thomson. Dopo averne diversi prove sperimentali per l'esistenza dell'elettrone, ha ribaltato la teoria dell'indivisibilità dell'atomo proposta da John Dalton.
Thomson, sulla base del suo modello, ha confermato e dimostrato l'esistenza di elettroni (particelle con carica elettrica negativa) nell'atomo, cioè l'atomo ha particelle subatomiche.
Mappa mentale: modello atomico Thomson
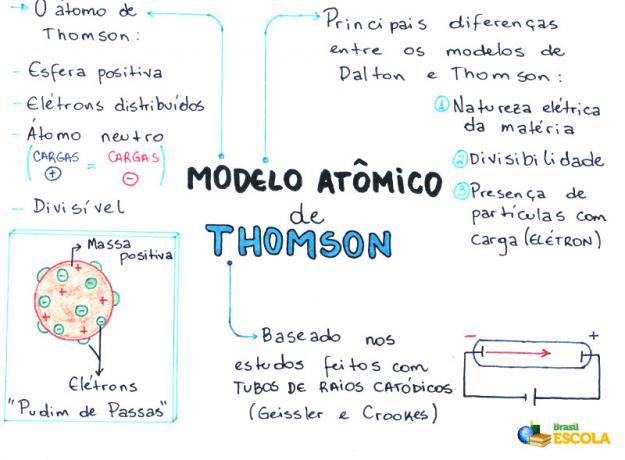
* Per scaricare la mappa mentale in PDF, Clicca qui!
Thomson ha proposto il suo modello atomico sulla base delle scoperte relative alla radioattività e degli esperimenti effettuati con il tubo a raggi catodici costruito dagli scienziati Geissler e Crookes. Guarda una rappresentazione di questo tubo:
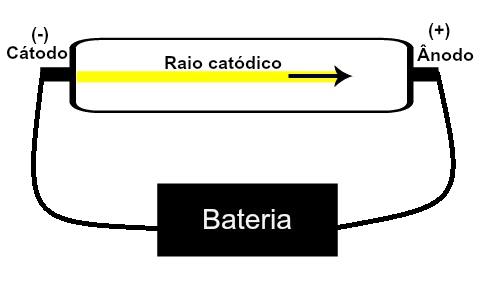
Quando un gas rarefatto a bassa pressione è sottoposto ad un'elevata tensione elettrica (es. 15000 V), produce un fascio di luce (composto da cariche elettriche) dal catodo (polo negativo) verso l'anodo (polo positivo).
Con questo esperimento, Thomson arrivò alla conclusione che quando gli atomi del materiale gassoso all'interno del tubo sono stati sottoposti ad un alto voltaggio, i loro elettroni sono stati strappati e diretti alla piastra positivo.
Considerazioni proposte dal modello atomico di Thomson
Con gli esperimenti effettuati con il tubo catodico, Thomson propose la sua interpretazione di come sarebbe stato l'atomo e la sua costituzione. Quindi, secondo lui:
- L'atomo è una sfera, ma non massiccia come proposto dal Modello atomico di John Dalton;
- L'atomo è neutro, poiché tutta la materia è neutra;
- Poiché l'atomo ha elettroni, che hanno cariche negative, quindi, deve avere particelle positive affinché la carica finale sia nulla;
- Gli elettroni non sono fissati o intrappolati nell'atomo, possono essere trasferiti ad un altro atomo in determinate condizioni;
- L'atomo può essere considerato come un fluido continuo con cariche positive dove si distribuirebbero gli elettroni, che hanno carica negativa;
- associato il tuo modello per un budino all'uvetta (che rappresentano gli elettroni);
- Poiché gli elettroni che vengono dispersi hanno la stessa carica, esiste tra loro una repulsione reciproca, che li rende uniformemente distribuiti nella sfera.
Novità proposte all'atomo dal modello Thomson
Il modello atomico di Thomson fu il secondo proposto per l'atomo. Il primo modello è stato formulato da John Dalton.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Il modello di Thomson riguardava nuove conoscenze sull'atomo che fino ad allora non erano state proposte per mancanza di basi scientifiche, come:
- Natura elettrica della materia;
- scindibilità dell'atomo;
- Presenza di piccole particelle cariche nell'atomo.
Problemi segnalati all'atomo di Thomson
Diversi fisici al momento della proposta del Modello atomico Thomson, basandosi sulle teorie della Fisica Classica, ha evidenziato alcune incongruenze presenti in questo modello:
- Thomson propose che l'atomo avesse una stabilità in relazione alla distribuzione uniforme degli elettroni, che poteva essere modificata dall'influenza dell'energia. Tuttavia, la fisica classica, basata su elettromagnetismo, non consente l'esistenza di un sistema stabile basato solo sulla repulsione tra particelle della stessa carica;
- Per Thomson, gli elettroni sono distribuiti uniformemente nell'atomo, ma hanno la capacità di spostamento in modo accelerato e, quindi, deve emettere radiazioni elettromagnetiche a determinate frequenze specifica. Tuttavia, questo non è stato osservato.
- Il modello di Thomson era spesso inefficace nello spiegare le proprietà atomiche come la loro composizione e organizzazione.
* Mappa mentale di Victor Ricardo Ferreira
Insegnante di chimica
Di Me. Diogo Lopes Dias
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
GIORNI, Diogo Lopes. "Il modello atomico di Thomson"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/o-atomo-thomson.htm. Consultato il 27 giugno 2021.
Chimica

Niels Bohr, atomo di Bohr, fisica atomica, atomo stabile, modello atomico, sistema planetario, strati dell'elettrosfera, livelli energetici, gusci elettronici, energia elettronica, modello atomico di Rutherford, atomo di stato eccitato.
Chimica

Atomi e costruzione dell'Universo, teoria atomica, che tutto è fatto, la materia è fatta di atomi, Teoria dei quattro elementi, antichi alchimisti, teoria atomica, particella fondamentale.


