oh cloruro di sodio (sale da tavola) è il sale che usiamo nella nostra vita quotidiana per salare cibi artigianali o trasformati (industrializzati). È una sostanza presente anche in vari alimenti naturali da noi consumati quotidianamente, come frutta, verdura, legumi, semi, ecc.
In questo testo saprai tutto su questa sostanza importante per la vita quotidiana dell'essere umano:
la definizione
Il cloruro di sodio appartiene alla funzione inorganica dei sali ed è composto dall'associazione del catione sodio (Na+) è il anione cLàoreto (Cl-) attraverso a legame ionico.
b) Caratteristiche chimiche
Il cloruro di sodio è formato da due elementi chimici:
→ Sodio (Na):
appartiene alla famiglia dei metalli (capaci di formare facilmente cationi) alcalini (AI);
ha un elettrone nel guscio di valenza;
ha numero atomico uguale a 11;
ha un'elevata elettropositività (capacità di perdere elettroni).
→ Cloro (Cl)
appartiene alla famiglia degli alogeni (VIIA);
è un non metallo (ecco perché diventa un anione così facilmente);
ha sette elettroni nel guscio di valenza;
ha numero atomico uguale a 17;
ha un'elevata elettronegatività (capacità di acquisire elettroni).
Poiché i due elementi chimici che formano il cloruro di sodio presentano, rispettivamente, elevata elettropositività e alta elettronegatività, tra loro c'è un legame ionico (stabilito tra atomi con tendenza a perdere e guadagnare elettroni).
La struttura chimica del cloruro di sodio è composta da un singolo anione cloruro (sfera verde), che interagisce con sei cationi di sodio (sfere blu), come si può vedere nella struttura sottostante:
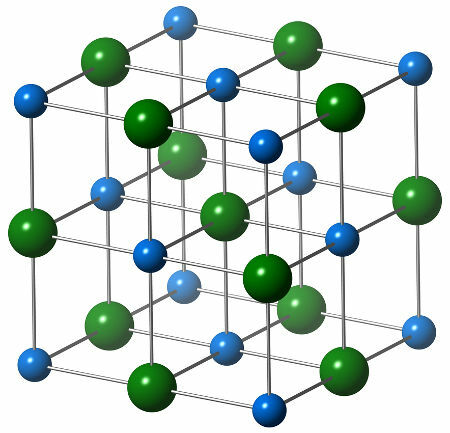
Rappresentazione della struttura cristallina del cloruro di sodio
c) Caratteristiche fisiche
Punto di fusione:
Il cloruro di sodio può essere trasformato da stato solido a stato liquido ad una temperatura di 801 oh.
Punto di ebollizione:
Il cloruro di sodio può essere trasformato da liquido a gassoso ad una temperatura di 1465 oh.
Polarità
Essendo una sostanza originata da un legame ionico, cioè essendo un composto ionico, il cloruro di sodio è polare.
solubilità in acqua
Possiamo sciogliere in 1 L di acqua, a 25 ohC, fino a 359 grammi di cloruro di sodio.
Solubilità in altri solventi:
Poiché il cloruro di sodio è un composto polare, non può essere sciolto in nessun solvente di natura non polare, come l'olio.
Densità:
La densità del cloruro di sodio è 2,165 g/mL, quindi è più denso dell'acqua, che ha una densità pari a 1 g/mL.
Conduttività elettrica:
Essendo un composto ionico, il cloruro di sodio è in grado di condurre una corrente elettrica solo quando:
-
È allo stato fuso, cioè liquido;
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Sciolto in acqua.
d) Modalità per ottenere
Il cloruro di sodio può essere ottenuto fisicamente o chimicamente:
1oh) Diventare fisico:
cristallizzazione frazionata
Il cloruro di sodio si ottiene facendo evaporare l'acqua dagli oceani.
miniere sotterranee
Viene estratto nelle miniere utilizzando tecniche minerarie.
depositi sotterranei
Si estrae da giacimenti profondi sotterranei sciogliendosi in acqua (il sale presente nel deposito si dissolve) e successivamente pompando.
2oh) Ottenendo chimicamente
reazione di sintesi
Il cloruro di sodio può essere ottenuto dalla reazione chimica di sintesi (sostanze semplici danno luogo a una sostanza composta) tra cloro gassoso e sodio metallico:
2 pollici(S) + Cl2(g) → 2 NaCl(S)
Reazione di neutralizzazione:
Un altro modo per ottenere chimicamente il cloruro di sodio è attraverso la reazione di neutralizzazione tra acido cloridrico e idrossido di sodio, in cui si ha la formazione di sale e acqua:
HCl(1) + NaOH(Qui) → NaCl(Qui) + H2oh(1)
e) Importanza per gli esseri umani
Il cloruro di sodio di per sé non ha alcuna funzione nel corpo umano, ma quando si dissocia in cationi di sodio (Na+) e anioni cloruro (Cl-), ciascuno di questi due ioni ha diverse importanti funzioni per il nostro organismo. Guarda alcune di queste funzioni:
→ Funzioni del catione sodio (Na+)
Previene la coagulazione del sangue;
Combatte la formazione di calcoli renali e biliari;
Partecipa alla regolazione dei fluidi corporei;
Partecipa alla regolazione della pressione sanguigna.
→ Funzioni dell'anione cloruro (Cl-)
Partecipazione alla formazione e costituzione del succo gastrico (acido cloridrico – HCl);
Partecipazione alla formazione del succo pancreatico.
f) Danni al corpo umano
Un consumo eccessivo di cloruro di sodio può causare i seguenti danni agli esseri umani:
→ Danni causati dall'eccesso di cationi di sodio nel corpo:
Aumento del tempo di guarigione della ferita;
Aumento dell'incidenza di crampi;
Aumento della pressione sanguigna;
Sovraccarico renale;
Aumento della ritenzione di liquidi nel corpo.
→ Danni causati da anioni cloruro in eccesso nel corpo:
distruzione di vitamina E;
Diminuzione della produzione di iodio nel corpo.
g) Altre applicazioni
Oltre ad essere utilizzato per salare gli alimenti, il cloruro di sodio può essere utilizzato anche nelle seguenti situazioni:
Produzione di shampoo;
Produzione di carta;
Produzione di Idrossido di sodio (NaOH);
Produzione detersivi;
Produzione di sapone;
Scioglimento della neve in luoghi che soffrono di bufere di neve;
Produzione di sodio metallico;
Produzione di gas di cloro;
Negli isotonici per la sostituzione degli elettroliti corporei;
In soluzioni decongestionanti nasali;
Produzione di soluzione salina; tra le altre applicazioni.
Di Me. Diogo Lopes Dias
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
GIORNI, Diogo Lopes. "Cloruro di sodio (sale da cucina)"; Scuola Brasile. Disponibile in: https://brasilescola.uol.com.br/quimica/cloreto-sodio.htm. Consultato il 27 giugno 2021.
Composti ionici, principali caratteristiche dei composti ionici, legame tra ioni, trasferimento definitivo di elettroni, forze di attrazione elettrostatica tra ioni, ioni negativi e positivi, anioni, cationi, legame ionico, struttura molecolare lui
Chimica

Legame ionico, disposizioni tra composti ionici, agglomerati ionici, cloruro di sodio, sale da cucina, sostanza ionica, forze di attrazione elettrostatiche, anioni cloruro, cationi sodio, solventi polari, ioni positivi, cationi, ioni negativi, anioni.



