- Scoperta:
Come si legge nel testo"Emissione alfa (α)”, il chimico neozelandese Ernest Rutherford eseguì un esperimento in cui collocò un campione di materiale radioattivo in un blocco di piombo, con un foro per dirigere le emissioni radioattive; e sottoponeva queste radiazioni a un campo elettromagnetico.
Tra i risultati ottenuti, Rutherford notò che un raggio di radiazione era stato attratto dalla piastra positiva, il che lo portò a concludere che queste emissioni erano di carica negativa. Questa radiazione è stata chiamata raggio emissioni beta (β).
Poiché i raggi subivano una deflessione quando venivano sottoposti a un campo elettromagnetico, ciò lo portò anche a concludere che in realtà erano composti da particelle che hanno massa. La massa di queste particelle, però, era inferiore a quella delle particelle che costituivano le emissioni alfa, perché le particelle subivano una deviazione maggiore.
- Costituzione:
Nel 1900 il fisico francese Antoine-Henri Bequerel (1852-1908) mise a confronto queste deviazioni subite dal particelle beta con gli spostamenti che gli elettroni hanno eseguito quando sono stati anche sottoposti a un campo elettromagnetico. Il risultato fu che erano uguali; con quello, si è visto che
le particelle beta erano in realtà elettroni.Di conseguenza, la rappresentazione di questa particella è data da 0-1β o β-. Si noti che l'emissione beta ha un numero di massa (A) uguale a zero, poiché gli elettroni non fanno parte del nucleo dell'atomo.
- Conseguenze dell'emissione di particelle beta per la struttura dell'atomo:
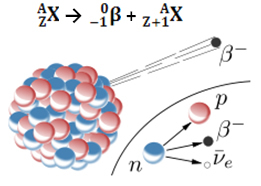
L'emissione di una particella beta (0-1β) è il risultato del riarrangiamento del nucleo instabile dell'atomo radioattivo al fine di acquisire stabilità. Si verifica quindi nel nucleo un fenomeno, in cui un neutrone si decompone, originando tre nuove particelle: un protone, un elettrone (particella β) e un neutrino. Vengono emessi l'antineutrino e l'elettrone; il protone, invece, rimane nel nucleo.
10no →11p + 0-1e + 00ν
neutrone protone elettrone neutrino
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Così, quando un atomo emette una particella beta, si trasforma in un nuovo elemento con lo stesso numero di massa (perché il neutrone che esisteva prima è stato “sostituito” dal protone), ma il suo numero atomico (Z = protoni nel nucleo) aumenta di un unità.
Vedi sotto come questo accade in modo generico:
Ecco un esempio di decadimento beta che si verifica con l'isotopo 14 dell'elemento carbonio:

La radiazione beta è costituita da elettroni emessi ad alta velocità dai nuclei di atomi radioattivi, questa velocità iniziale va da 100 000 km/s a 290 000 km/s e raggiunge il 95% della velocità del leggero.
La massa della radiazione è la stessa di quella di un elettrone, che è 1840 volte più piccola di quella di un protone o di un neutrone. La radiazione alfa (α) emette due protoni e due neutroni, quindi la massa delle particelle α è 7360 volte quella delle particelle. Questo spiega il fatto che le particelle α subiscono una deviazione minore delle particelle β, come aveva verificato Rutherford nel suo esperimento.
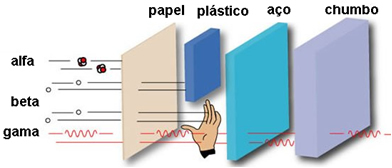
- Potere di penetrazione:
Il suo potere di penetrazione è medio, essendo da 50 a 100 volte più penetrante delle particelle alfa. Questi possono passare attraverso un foglio di carta, ma sono trattenuti da un foglio di soli 2 mm di piombo o di 2 cm di alluminio. Quando colpiscono il corpo umano, possono penetrare fino a 2 cm.
- Danni all'uomo:
Poiché il suo potere di penetrazione sul corpo umano è di soli 2 cm, le particelle possono penetrare nella pelle, provocando ustioni, ma vengono fermate prima di raggiungere gli organi più interni del corpo.
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "problema beta"; Scuola Brasile. Disponibile in: https://brasilescola.uol.com.br/quimica/emissao-beta.htm. Consultato il 27 giugno 2021.