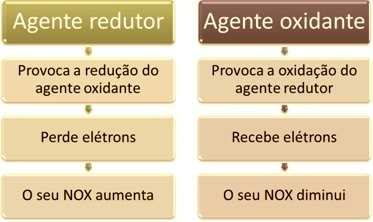
Una delle caratteristiche principali che contraddistinguono una reazione di ossidoriduzione (o redox) degli altri è la presenza di un agente ossidante e di un agente riducente, che possono essere definiti come segue:
Ad esempio, guarda la reazione chimica di seguito in cui l'alluminio (Al) si corrode in una soluzione acquosa di acido cloridrico (HCl). Gli atomi di alluminio trasferiscono elettroni ai cationi H+(Qui) e produrre il catione Al3+(Qui):
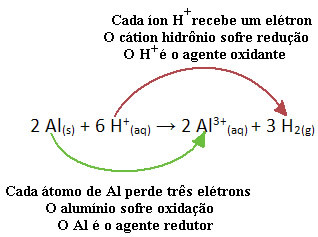
Si noti che poiché Al ha trasferito elettroni, ciò significa che ha causato la riduzione dei cationi H+(Qui); per questo si chiama agente riducente. Già il catione H+(Qui) rimosso gli elettroni dall'alluminio, causando ossidazione di quel metallo; quindi agisce come a agente ossidante.
Nella vita di tutti i giorni, ci sono molti esempi delle prestazioni degli agenti ossidanti e degli agenti riducenti. Guardane qualcuna e ricorda, però, che in tutti i casi la riduzione avviene contemporaneamente all'ossidazione; quindi, se c'è un agente riducente, c'è anche un agente ossidante.
- Esempi di agenti riducenti:
- Nei film fotografici: le pellicole fotografiche contengono sali d'argento sensibili alla luce. Nei punti dove c'è incidenza della luce c'è una riduzione degli ioni Ag+, con conseguente contrasto osservato nei negativi.

- Vitamina C: La vitamina C (acido L-ascorbico) è un potente agente riducente in soluzione acquosa. Ha un'eccezionale facilità di ossidazione ed è per questo che è ampiamente utilizzato, soprattutto in alimenti come a antiossidante, cioè si aggiunge ad altri alimenti e li protegge da possibili ossidazioni, dovute proprio its sacrificio. Un esempio sono i frutti come mele e pere che a contatto con l'ossigeno dell'aria si scuriscono perché si ossidano. Ma quando si aggiunge alla frutta una piccola quantità di succo d'arancia o di limone (che contengono vitamina C) tagliato, questo impedisce che si verifichi questa reazione, perché la vitamina C agisce come agente riducente e si ossida prima del frutto.

- Gas idrogeno: il gas idrogeno (H2) è utilizzato nella propulsione a razzo ed è considerata una delle alternative energetiche più importanti, poiché la sua combustione rilascia una grande quantità di energia e non inquina. In questa reazione, l'idrogeno agisce come agente riducente, essendo ossidato dall'ossigeno.
- Esempi di agenti ossidanti:
- Nella produzione di aceto: quando il vino è esposto all'aria, si trasforma in aceto, il cui componente principale è l'acido acetico. Questo perché l'alcol etilico o etanolo presente nel vino si ossida a contatto con l'ossigeno atmosferico, dando origine all'acido acetico. Pertanto, l'ossigeno è un agente ossidante. Anche l'origine del termine “ossidazione” è legata alla reazione con l'ossigeno.

Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
- Nella ruggine: come detto nell'esempio precedente, l'ossigeno agisce come agente ossidante per l'alcol; e lo fa anche a contatto con vari metalli, come il ferro, provocando il processo di arrugginimento. Oltre all'ossigeno nell'aria, altri agenti ossidanti in questo caso sono l'acqua o una soluzione acida.
- In candeggina: l'effetto sbiancante dei candeggianti è dovuto alla presenza dei seguenti due agenti riducenti: o anione ipoclorito (generalmente sotto forma di sale sodico – NaOCl), presente ad esempio nella candeggina; e perossido di idrogeno (H2oh2), commercializzato come perossido di idrogeno. Questi due composti hanno una tendenza molto forte ad ossidarsi e causare la riduzione di altre specie chimiche. Pertanto, sono responsabili delle sostanze ossidanti che conferiscono colore scuro ai prodotti. Ad esempio, nella cellulosa, la lignina si scompone e diventa più leggera e malleabile. Nel caso della smacchiatura e dello sbiancamento dei tessuti, questi agenti ossidanti provocano l'ossidazione di molecole organiche come grassi e coloranti.

- Negli etilometri: un semplice etilometro monouso è costituito da un tubo trasparente contenente una soluzione acquosa del sale bicromato di potassio e silice, inumidita con acido solforico; mescolato con il colore arancione. Questo sale, a contatto con il vapore alcolico contenuto nell'alito del guidatore ubriaco, reagisce, modificando il colore in verde. Ciò significa che viene provocata l'ossidazione dell'etanolo (alcol) in etanale.

di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Concetto ed esempi di agente riducente e agente ossidante"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/conceito-exemplos-agente-redutor-agente-oxidante.htm. Consultato il 28 giugno 2021.
Chimica

Acciaio resistente alla corrosione atmosferica, Cromo, Nichel, prodotto da ghisa in altoforno, resistenza a ossidazione ad alta temperatura, acciaio inossidabile, gruppo di leghe ferrose resistenti all'ossidazione e alla corrosione, produzione di parti per veicolo
Chimica

Come funziona l'etilometro, concentrazione di alcol, etilometro, reazioni che coinvolgono l'alcol etilico, tipi di etilometro, dicromato di potassio, cella a combustibile, catalizzatore, rilascio di elettroni, acido acetico, idrogeno, concetto
Chimica

Lenti fotosensibili, reazioni di ossidoriduzione, perdita o acquisizione di elettroni, lenti fotosintetiche negli occhiali da sole, composizione del vetro fotocromatico, atomi di ossigeno tetraedrici, struttura cristallina del cloruro d'argento, luce ultravioletta, metallo argentato


