Acido cloridrico è un idraacido con alto potenziale di ionizzazione, è un liquido giallastro, altamente corrosivo e tossico. Viene utilizzato in vari processi industriali, come la produzione di prodotti per la pulizia e cloridrati farmaceutici, negli alimenti e nei processi di produzione dell'acciaio.
È presente anche nell'organismo umano; oh succo gastrico che agisce nella digestione di proteine è una soluzione acida; di acido cloridrico e altre sostanze, come enzimi e sali. Esposizione, inalazione o ingestione di l'acido cloridrico concentrato è altamente dannoso per la salute, che può anche causare la morte.
Leggi anche: Acido solforico - sostanza che ha un alto potere corrosivo
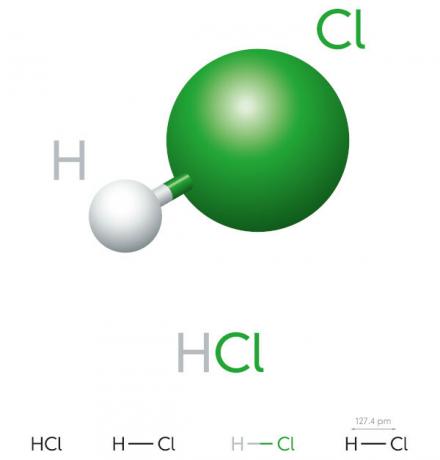
Proprietà dell'acido cloridrico
- composto inorganico
- acido forte
- Alto potenziale di ionizzazione
- Liquido
- aspetto giallastro
- Tossico
- Corrosivo
- Volatile
- Igroscopico (tende ad assorbire áacqua dell'ambiente)
- Solubile in acqua
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Produzione di acido cloridrico
L'acido cloridrico era scoperto da un alchimista musulmano chiamato Jabir Ibne Haiane, noto anche come Gaber e considerato il padre della chimica araba. Ha sintetizzato la sostanza sulla base di a reazione tra il sale marino (NaCl) e il acido solforico (A2SOLO4).
2NaCl + H2SOLO4 → In2SOLO4 + 2HCl
Attualmente acido cloridrico è prodotto su larga scala attraverso il elettronicoólisi di cloruro di sodio in soluzione acquosa. Da questo processo si ottiene il gas cloro (Cl2), gas idrogeno (H2) e idrossido di sodio (NaOH). I gas di cloro e idrogeno reagiscono per formare acido cloridrico:
Cl2 + H2 → 2HCl
Tuttavia, questa reazione è estremamente esotermico e altamente pericoloso. Attualmente, la maggior parte dell'acido cloridrico prodotto industrialmente è associato alla produzione di composti organici, essendo un processo più economico e sicuro.
R-H + Cl2 → R-Cl + HCl
(Considera R un radicale organico.)
Vedi anche: Suggerimenti per determinare-Se la forza degli acidi

Applicazione di acido cloridrico
- Decapaggio del metallo: L'acido cloridrico viene utilizzato per "pulire" i metalli prima che vengano lavorati, rimuovendo ruggine, incrostazioni e altre impurità dalla loro superficie.
- Produzione di composti organici: l'acido cloridrico viene utilizzato come reagente per ottenere il cloruro di vinile, che viene utilizzato nella produzione di materie plastiche. L'acido cloridrico proviene anche dal cloroprene, che viene utilizzato nelle gomme sintetiche.
- Produzione di composti inorganici: l'acido cloridrico è presente in diversi processi industriali per la produzione di reagenti e composti inorganici, tra questi ci sono prodotti per il trattamento delle acque, come cloruro di ferro (III) e alluminio.
- Usato come prodotto per la pulizia: Commercializzato anche come acido muriatico, l'acido cloridrico viene utilizzato per la pulizia post-costruzione, domestica e chimica di strumenti e macchinari.
- Trasformazione dei prodotti alimentari: L'acido cloridrico viene utilizzato in varie reazioni per la produzione di alimenti e additivi, come l'idrolisi dell'amido e delle proteine, o nel prodotto finale per l'equilibrio del pH.
- Produzione di farmaci: L'acido cloridrico è utilizzato nella produzione di cloridrati solubili presenti in diversi farmaci, come la doxiciclina cloridrato, utilizzata nel trattamento di tifo e vaiolo.
Acido cloridrico nel corpo
L'acido cloridrico è presente nel nostro apparato digerente, il succo gastrico prodotto dal nostro stomaco è una soluzione di acqua, enzimi, acido cloridrico, sali inorganici e una piccola percentuale di acido lattico.
oh la torta alimentare si trasforma in chimo, una massa acida (grazie all'azione del succo gastrico e alla sua composizione acida), questo è quando il digestione di proteine, trasformato in polipeptidi e aminoacidi che sarà assorbito dal corpo.
Rischi dell'acido cloridrico
L'acido cloridrico è un acido molto forte e corrosivo, quindi il contatto con la sostanza provoca diversi danni:
- Pelle: Provoca ustioni e irritazioni.
- occhi: Provoca grave irritazione e può causare cecità.
- Inalazione: Provoca irritazione e lesioni alle vie aeree superiori.
- ingestione: provoca corrosione in tutto il sistema orale, e nel tratto gastrointestinale, può causare vomito, sanguinamento, diarrea, problemi di circolazione, che possono portare alla morte.
- Esposizionecontinua: attacca per prime le mucose, provocando dermatiti e congiuntivite, gengive sanguinanti, fotosensibilizzazione; l'inalazione frequente, anche a bassa concentrazione del composto, può causare gastrite e sangue dal naso.
Accedi anche a: Caratteristiche e proprietà dell'acido acetico

esercizi risolti
Domanda 1 - (Udesc) Per quanto riguarda l'acido cloridrico, si può affermare che:
A) in soluzione acquosa permette il passaggio di corrente elettrica.
B) è un diacido.
C) è un acido debole.
D) ha un basso grado di ionizzazione.
E) è una sostanza ionica.
Risoluzione
Alternativa A. L'acido cloridrico non è un diacido, in quanto ha un solo H ionizzabile, ma uno acido forte, sostanza molecolare ad alto potenziale di ionizzazione. IL ionizzazione in mezzo acquoso favorisce la conduzione di corrente elettrica a causa dell'esistenza di ioni liberi.
Domanda 2 - In una soluzione di acido cloridrico e acqua si può dire che la presenza di acido cloridrico molecolare (HCl) è minima, questo perché
A) L'acido cloridrico a contatto con l'acqua viene diluito.
B) l'acido cloridrico è una sostanza che non si solubilizza in acqua.
C) l'acido cloridrico ha un alto potenziale di ionizzazione, quindi, quando in un mezzo acquoso, la molecola di HCl forma ioni H+ Cl-.
D) l'acido cloridrico, essendo molto volatile, si separa dalla soluzione lasciando solo molecole d'acqua.
E) l'acido cloridrico è una sostanza ionica, quindi, in una soluzione acquosa, si dissocia formando ioni.
Risoluzione
Alternativa C.
A) La risposta non concorda con la domanda, la diluizione dell'acido cloridrico in acqua non giustifica l'assenza di HCl molecolare.
B) Errato, l'acido cloridrico è solubile e ha un'affinità per l'acqua.
C) Corretto
D) Sebbene l'acido cloridrico sia volatile, questa segregazione delle due specie nella soluzione non si verifica in modo significativo.
E) L'acido cloridrico è una soluzione di acido cloridrico e acqua, dove l'acido cloridrico è una sostanza molecolare non ionica.
Di Laysa Bernardes Marques de Araujo
Insegnante di chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
ARAúJO, Laysa Bernardes Marques de. "Acido cloridrico"; Scuola Brasile. Disponibile in: https://brasilescola.uol.com.br/quimica/Acido-cloridrico.htm. Consultato il 27 giugno 2021.


