Satu larutan penyangga adalah campuran yang digunakan untuk mencegah pH atau pOH medium berubah ketika asam kuat atau basa kuat ditambahkan.
Ada dua jenis larutan penyangga:
1. Campuran asam lemah dengan basa konjugasinya;
2. Campuran basa lemah dengan asam konjugasinya.
Mari kita lihat contoh masing-masing dan cara kerjanya ketika sejumlah kecil asam atau basa kuat ditambahkan ke media:
1. Campuran asam lemah dengan basa konjugasinya:
Untuk membentuk larutan seperti itu, asam lemah dicampur dengan garam dari anion yang sama dengan asam.
Misalnya, pertimbangkan larutan buffer yang terdiri dari asam asetat (H3COOH(sini)) dan natrium asetat (H3CCOONa(s)). Lihat bahwa keduanya memiliki anion asetat: (H3CCOO-(sini)). Konsentrasi ion-ion ini praktis karena disosiasi garam, yang besar. Ionisasi asam kecil.

Sekarang perhatikan apa yang terjadi dalam kemungkinan penambahan berikut:
- Penambahan sejumlah kecil asam kuat:
Penambahan asam kuat meningkatkan konsentrasi ion hidronium, H3HAI+1, dan karena asam asetat adalah asam lemah, anion asetat memiliki afinitas tinggi terhadap proton (H
+) hidronium. Dengan cara ini, mereka bereaksi dan lebih banyak asam asetat terbentuk:
Akibatnya, pH medium praktis tidak berubah. Namun, jika asam kuat semakin banyak ditambahkan, saatnya akan tiba ketika semua anion asetat akan dikonsumsi dan efek buffering akan berhenti.
- Penambahan sedikit basa kuat:
Penambahan basa kuat meningkatkan konsentrasi ion OH-. Tetapi ion-ion ini dinetralkan oleh ion H H3HAI+1 dilepaskan dalam ionisasi asam asetat:

Dengan reaksi ini, konsentrasi ion H3HAI+1(sini) akan menurun dan akan terjadi pergeseran kesetimbangan ke arah peningkatan ionisasi asam sehingga variasi pH larutan akan sangat kecil. Konsentrasi ion H3HAI+1(sini) itu akan praktis konstan.
Jangan berhenti sekarang... Ada lagi setelah iklan ;)
Dalam hal ini juga ada batas cap kapasitas. Oleh karena itu, jika kita menambahkan lebih banyak basa, keseimbangan ionisasi asam akan semakin bergeser ke arah ionisasinya, sampai semua asam habis.
2. Campuran basa lemah dengan asam konjugasinya:
Jenis larutan penyangga ini terdiri dari basa lemah dan larutan garam yang mengandung kation yang sama dengan basa.
Misalnya, pertimbangkan larutan buffer yang dibentuk oleh magnesium hidroksida, MgOH2 (aq) (basa lemah) dan magnesium klorida, MgCl2(s) (garam). Keduanya mengandung kation magnesium (Mg2+(sini)). Ion magnesium yang ada dalam medium hampir semuanya berasal dari disosiasi garam, karena disosiasi basa lemah:
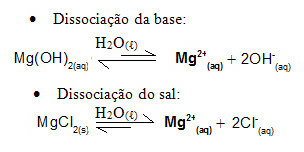
- Penambahan sejumlah kecil asam kuat:
Dalam hal ini, ion H3HAI+1 yang berasal dari penambahan asam kuat akan dinetralkan oleh ion OHOH-, berasal dari disosiasi basa lemah. Ini akan menggeser keseimbangan disosiasi dasar ke kanan.
Dengan demikian, variasi pH (jika ada) akan sangat kecil, karena konsentrasi ion OH- tetap konstan. Efek buffering akan berhenti ketika seluruh basis dipisahkan.
- Penambahan sedikit basa kuat:
Basa kuat yang ditambahkan mengalami disosiasi melepaskan ion OH-. Karena magnesium hidroksida adalah basa lemah, magnesium yang dilepaskan pada disosiasi dari garam akan memiliki kecenderungan lebih besar untuk bereaksi dengan OH--:

Oleh karena itu, peningkatan ion OH- diimbangi oleh peningkatan proporsional dalam Mg(OH)2 (aq). Dengan demikian, pH tidak mengalami perubahan besar.
Efek ini berakhir ketika semua kation magnesium telah dikonsumsi.
Oleh Jennifer Fogaa
Lulus kimia
Apakah Anda ingin mereferensikan teks ini di sekolah atau karya akademis? Lihat:
FOGAÇA, Jennifer Rocha Vargas. "Apa itu larutan penyangga?"; Sekolah Brasil. Tersedia di: https://brasilescola.uol.com.br/quimica/o-que-uma-solucao-tampao.htm. Diakses pada 28 Juni 2021.
Kimia

Uji pengetahuan Anda dan pelajari lebih lanjut dengan daftar latihan soal neraca kimia ini. Melalui materi ini, Anda akan dapat lebih memahami cara kerja konstanta kesetimbangan (Kp, Kc dan Ki), pergeseran kesetimbangan, pH dan pOH, serta kesetimbangan dalam larutan penyangga.
Solusi, Solusi Padat. Larutan cair, larutan gas, larutan yang dibentuk oleh gas dan cairan, larutan yang dibentuk oleh cairan.


