Sebagian besar materi yang ditemukan di alam, dalam masyarakat kita dan dalam tubuh kita bukanlah zat murni, tetapi, pada kenyataannya, campuran dari dua atau lebih zat.
Meskipun kita sering menyebut air mineral hanya sebagai “air”, pada kenyataannya tidak hanya mengandung zat murni H2O, karena itu adalah hasil proses di mana air hujan menembus tanah dan melewati berbagai batuan.
Jadi, sesuai namanya, selain air, ia juga memiliki beberapa mineral terlarut. Jika Anda penasaran untuk memeriksa label air mineral apa pun, Anda akan melihat komposisinya kimia strontium sulfat, kalsium, natrium, kalium, natrium bikarbonat, natrium fluorida, di antara orang lain.
Peta Pikiran: Campuran
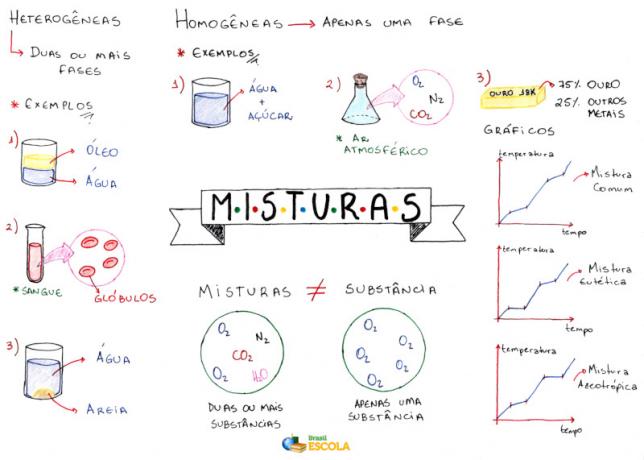
* Untuk mengunduh peta pikiran dalam PDF, Klik disini!
Bagaimana cara membedakan zat dari campuran?
Air suling yang ditunjukkan di bawah ini adalah zat murni yang hanya mengandung H2HAI:

Air suling yang digunakan di laboratorium
Secara visual, itu terlihat persis seperti campuran air dan garam; namun, mereka dapat dibedakan dari definisi campuran. Lihat:
→ Campuran adalah bahan yang sifat fisiknya tidak tetap, tetapi berubah-ubah pada suhu dan tekanan tertentu.
Jadi, ukur saja properti fisik, seperti titik leleh dan titik didih dan densitas. Jika mereka konstan dan terdefinisi dengan baik, itu adalah zat murni (dalam kasus air suling, pada 4°C, massa jenisnya adalah 1,0 g/cm3 dan, di permukaan laut, titik leleh dan titik didih masing-masing adalah 0°C dan 100°C).
Namun, jika variasi disajikan, itu adalah campuran. Jika Anda memanaskan campuran air-garam untuk memeriksa titik didih, Anda akan melihat bahwa selama perubahan dari keadaan cair ke gas, suhu tidak tetap konstan, seperti air suling, yang tetap pada 100 °C sampai semua cairan berubah uap.
Sekarang ada campuran bahwa bahkan tidak perlu menentukan sifat fisiknya untuk mengetahui bahwa mereka adalah campuran, lihat saja, seperti halnya dengan campuran air dan minyak berikut:

Campuran yang dibentuk oleh air dan minyak
Ini menunjukkan bahwa ada berbagai jenis campuran, yang dapat diklasifikasikan menjadi: homogen dan heterogen. Lihat masing-masing:
Campuran Homogen:
Mereka adalah mereka yang memiliki penampilan seragam, dengan fase tunggal (Fase tunggal). Contoh:
garam (0,9 g natrium klorida dalam 100 ml air);
air garam (36 g garam seperti natrium klorida, magnesium klorida, kalium iodat, anti humektan, dan 100 ml air);
alkohol terhidrasi (etanol dan air);
udara (78% gas nitrogen, 20% gas oksigen, 2% gas lain dan uap air);
baja (paduan logam yang dibentuk oleh 98,5% besi dan 1,5% karbon).

Garam, baja dan formaldehida, contoh campuran homogen
Contoh di atas menunjukkan bahwa campuran homogen mereka bisa dalam keadaan padat, cair atau gas. Campuran homogen ini disebut solusi dan mereka tidak dapat dipisahkan dengan metode fisik, tetapi hanya dengan teknik kimia. Untuk memisahkan alkohol dari air, misalnya, perlu dilakukan proses: distilasi, karena sentrifugal atau penyaringan itu tidak akan berhasil.
Selain itu, penting untuk ditekankan bahwa mereka harus homogen bahkan ketika melihat di bawah ultramikroskop. Untuk mata telanjang, susu dan darah, misalnya, mungkin tampak homogen, tetapi di bawah ultramikroskop kita melihat bahwa sebenarnya mereka adalah heterogen. Lihat gambar darah di bawah ultramikroskop dan fase terpisahnya setelah ditempatkan dalam ultrasentrifugasi:
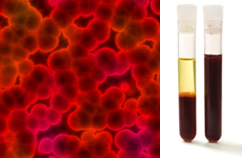
Gambar mikroskopis dan fase darah
Campuran Heterogen:
Apakah mereka yang memiliki lebih dari satu fase. Contoh: air dan minyak, air dan pasir, es dan air, granit, air dan besi, garam yang tidak larut dalam air, dll.
Komponen dari campuran heterogen mereka muncul, dalam banyak kasus, dalam keadaan fisik yang berbeda dan dapat dipisahkan dengan metode fisik. Contoh terjadi ketika kita membuat kopi dan menyaring padatan, memisahkannya dari cairan.
Tetapi ini tidak selalu terjadi, seperti yang ditunjukkan dalam kasus minyak dan air, yang, meskipun keduanya cair, tidak larut karena perbedaan polaritas molekulnya.
Peta mental Oleh Ibu Victor Ricardo Ferreira
guru kimia
Oleh Jennifer Fogaa
Lulus kimia
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/tipos-misturas.htm