Hibridisasi adalah nama yang diberikan untuk fusi atau penyatuan orbital atom yang tidak lengkap, sebuah fenomena yang meningkatkan jumlah ikatan kovalen yang dapat dilakukan oleh atom. Mengingat bahwa orbital adalah wilayah atom di mana ada kemungkinan lebih besar untuk menemukan elektron.
Untuk mengetahui jumlah ikatan yang dibuat atom dan memahami fenomena hibridisasi, perlu diketahui beberapa hal mendasar tentang atom:
1HAI titik: sublevel energi
Sublevel energi yang dapat dimiliki atom adalah s, p, d, f.
2HAI titik: jumlah orbital per sublevel
Setiap sublevel energi memiliki jumlah orbital yang berbeda, seperti yang dapat kita lihat di bawah ini:
Sublevel s: 1 orbital;
p sublevel: 3 orbital;
Sublevel d: 5 orbital.
Representasi generik dari orbital ini dilakukan sebagai berikut:
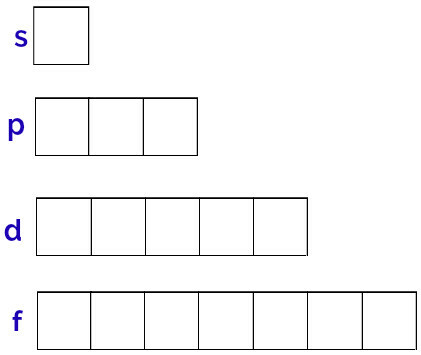
Representasi orbital dari setiap sublevel
Menurut Pauli, orbital dapat memiliki maksimal 2 elektron, dengan berputar (gerakan memutar) berlawanan.
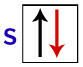
Representasi orbital s dengan elektronnya
Menurut Hund, orbital dari sublevel hanya menerima elektron kedua ketika semua orbital lain dari sublevel itu telah menerima elektron pertama.
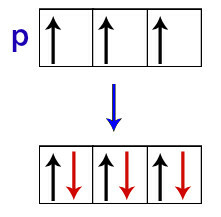
Distribusi elektron dalam orbital sublevel p
3HAI titik: distribusi elektronik
Untuk memahami hibridisasi dan jumlah ikatan yang dibuat atom, penting untuk melakukan distribusi elektronik pada diagram Linus Pauling.

Diagram Linus Pauling
Mengingat bahwa jumlah maksimum elektron di setiap sublevel adalah:
s = 2 elektron;
p = 6 elektron;
d = 10 elektron;
f = 14 elektron.
Setelah ulasan singkat ini, kita dapat mendefinisikannya sekarang apa itu hibridisasi. Untuk ini, kita akan menggunakan unsur kimia boron (nomor atom = 5) sebagai contoh.
Ketika kami melakukan distribusi boron elektronik, kami memiliki:
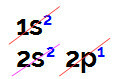
Distribusi boron elektronik dalam diagram Linus Pauling
Dimungkinkan untuk mengamati dalam distribusi ini bahwa boron memiliki 2 elektron di sublevel s dan 1 elektron di sublevel p lapisan valensi.
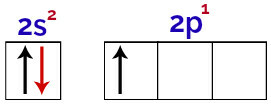
Elektron dalam orbital lapisan valensi boron
Karena boron memiliki 1 orbital yang tidak lengkap, maka boron seharusnya hanya membuat satu ikatan kovalen, karena jumlah ikatan selalu berbanding lurus dengan jumlah orbital yang tidak lengkap.
Jadi, ketika atom boron menerima energi dari lingkungan luar, elektronnya, terutama yang berada di kulit valensi, menjadi tereksitasi. Hal ini menyebabkan salah satu elektron dari orbital s keluar dan menempati salah satu orbital p yang kosong, sehingga menghasilkan 3 orbital atom yang tidak lengkap, seperti terlihat pada gambar berikut:

Representasi keadaan tereksitasi dari atom boron
Akhirnya, terjadi penyatuan orbital s yang tidak lengkap dengan orbital p yang tidak lengkap. Persatuan ini disebut hibridisasi. Karena kita memiliki fusi orbital s dengan dua p, itu disebut hibridisasi sp2.
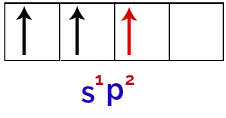
Representasi orbital hibridisasi dalam atom boron
Selain boron, beberapa unsur kimia lain mengalami fenomena hibridisasi, seperti belerang (S), Xenon (Xe), fosfor (P), karbon (Ç), berilium (Menjadi).
Oleh Saya Diogo Lopes Dias
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-hibridizacao.htm