Kita dapat mencatat bahwa setiap kali kita meningkatkan konsentrasi satu atau semua reaktan yang berpartisipasi dalam reaksi kimia, ada peningkatan laju perkembangannya, yaitu kecepatan reaksi.
Kebalikannya juga benar. Misalnya, saat ini direkomendasikan agar kita menggunakan gel alkohol daripada alkohol biasa, karena risiko terbakarnya lebih kecil dan dengan demikian menghindari kecelakaan. Alkohol cair biasa sebenarnya adalah campuran alkohol dan air, dengan alkohol gel yang mengandung lebih sedikit alkohol. Oleh karena itu, ketika konsentrasi salah satu reaktan pembakaran dikurangi, dalam kasus alkohol, reaksi berlangsung lebih lambat. Sebaliknya, semakin murni alkohol, semakin cepat reaksi pembakaran.

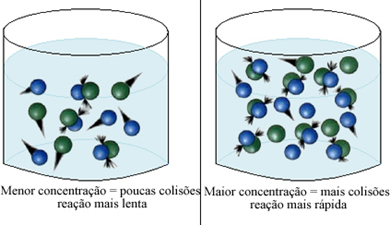
Seperti yang dinyatakan dalam teks Kondisi Terjadinya Reaksi Kimia, salah satu syarat terjadinya suatu reaksi adalah tumbukan efektif antara partikel. Jadi, peningkatan konsentrasi reagen memungkinkan untuk memiliki lebih banyak partikel atau molekul yang terkurung dalam ruang yang sama. Hal ini meningkatkan jumlah tumbukan di antara mereka dan juga meningkatkan kemungkinan terjadinya tumbukan efektif yang akan mengakibatkan terjadinya reaksi. Akibatnya reaksi berlangsung lebih cepat.
Untuk melihat ini, pikirkan contoh berikut: ketika kita memiliki bara api dan kita ingin pembakaran ini berlangsung lebih cepat, apakah kita meniup atau mengipasi bara? Mengapa ini berhasil?
Nah, salah satu reaktan dalam reaksi pembakaran ini adalah oksigen di udara. Saat kita mengocok, arus udara menghilangkan abu yang terbentuk selama pembakaran dan ini memfasilitasi kontak oksigen dengan bara. Dengan cara ini, kami meningkatkan kontak antara reaktan dan mempercepat reaksi pembakaran.
Secara singkat, kami memiliki:

Ketika bekerja dengan gas, salah satu cara untuk meningkatkan konsentrasi reaktan adalah turunkan tekanan. Ketika kita melakukan ini, kita mengurangi volume dan, akibatnya, ada peningkatan konsentrasi reagen.

Oleh Jennifer Fogaa
Lulus kimia
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/concentracao-dos-reagentes-velocidade-das-reacoes.htm


