Kesetimbangan dinamis atau kesetimbangan kimia dari suatu reaksi terjadi ketika reaksi maju dan reaksi balik terjadi secara bersamaan. Apa yang disebut sistem reversibel ini diwakili oleh panah di kedua arah:  atau
atau  . Contoh reaksi reversibel dikutip pada gambar di atas, antara gas yodium dan gas hidrogen.
. Contoh reaksi reversibel dikutip pada gambar di atas, antara gas yodium dan gas hidrogen.
Pada awal reaksi, jumlah reaktan maksimum dan produk adalah nol. Namun, reaktan bereaksi satu sama lain, mengurangi konsentrasinya dan meningkatkan produk yang terbentuk. Laju perkembangan reaksi langsung juga menurun.
Ketika konsentrasi produk meningkat, reaksi terbalik dimulai dan reaktan terbentuk lagi; laju perkembangan reaksi terbalik juga meningkat.
Setelah mencapai kesetimbangan kimia, pada suhu konstan, laju perkembangan reaksi maju dan reaksi balik adalah sama.
Semualangsung = Semua terbalik
Tarifnya sama, tetapi konsentrasinya tidak. Konsentrasi reagen dan produk tidak mungkin sama. Hanya dalam kasus yang jarang terjadi hal ini terjadi. Dalam kebanyakan kasus konsentrasi reagen akan lebih tinggi dari produk atau sebaliknya.
Dengan demikian, kami memiliki tiga cara yang mungkin untuk secara grafis mewakili tingkat pengembangan: reaksi langsung dan reaksi terbalik, yang menghubungkan konsentrasi reaktan dan produk selama waktu. Mari kita lihat setiap kasus:
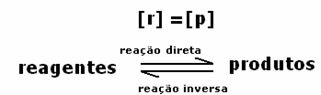
kasus pertama: Konsentrasi yang sama:
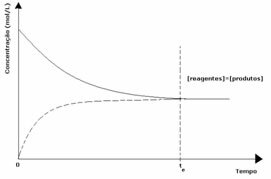
Seperti yang terlihat pada grafik, pada waktu tdan reaksi maju dan reaksi balik sama, dalam hal ini konsentrasi reaktan dan produk sama. Dengan demikian, keseimbangan tidak bergeser ke kedua sisi, intensitas kedua reaksi adalah sama, seperti yang dinyatakan di bawah ini:
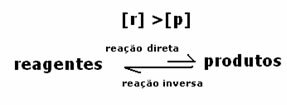
kasus ke-2: Konsentrasi reagen lebih besar dari konsentrasi produk:
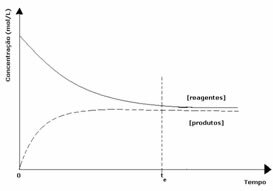
Dalam hal ini, diamati bahwa ketika mencapai kesetimbangan, konsentrasi reaktan lebih besar daripada produk. Dengan demikian, disimpulkan bahwa semakin banyak reaktan, maka reaksi kebalikannya terjadi dengan intensitas yang lebih besar. Reaksi digeser ke kiri:
kasus ke-3: Konsentrasi produk lebih besar dari reagen:
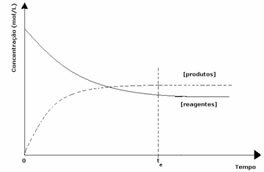
Karena pada kesetimbangan konsentrasi produk lebih besar, ini berarti bahwa reaksinya adalah digeser ke kanan, karena reaksi langsung (dengan pembentukan produk) terjadi dengan lebih besar intensitas.
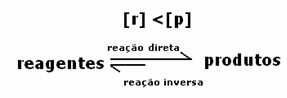
Apa yang akan menunjukkan apakah reaksi cenderung ke kanan atau ke kiri adalah tetapan kesetimbangan K, yang hanya bergantung pada suhu.
Oleh Jennifer Fogaa
Lulus kimia
Tim Sekolah Brasil
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/estudo-grafico-equilibrio-quimico.htm
