Ciri pembeda utama dari reaksi redoks adalah bahwa secara bersamaan satu spesies kimia kehilangan elektron (dengan mengoksidasi) dan spesies lain memperoleh elektron (dengan mereduksi).
Namun, dalam reaksi tertentu dimungkinkan untuk mengamati bahwa tidak hanya ada oksidasi dan/atau reduksi. Di bawah ini adalah contoh:
SnS + HCl + HNO3 → SnCl4 + S + TIDAK + H2HAI
Menghitung bilangan oksidasi (Nox) dari semua atom dalam reaksi ini, seperti yang diajarkan dalam teks “Penentuan Bilangan Oksidasi (Nox)”, kita memiliki:
+2 -2 +1 -1 +1 +5 -2 +4 -1 0 +2 -2 +1 -2
SnS + HCl + HNO3 → SnCl4 + S + TIDAK + H2HAI
Yuk cek sekarang yang manazat mengalami variasi dalam Nox mereka dan, akibatnya, yang teroksidasi dan tereduksi:
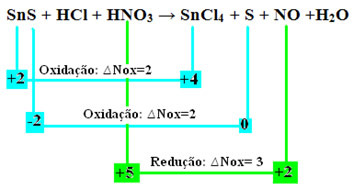
Perhatikan bahwa dua oksidasi telah terjadi. Jadi, dalam hal ini, bagaimana menyetarakan persamaan kimia?
Satu hal penting yang perlu diingat yang berlaku untuk semua reaksi redoks adalah bahwa jumlah elektron yang diberikan harus selalu sama dengan jumlah elektron yang diterima.
Oleh karena itu, untuk menyetarakan jenis reaksi ini, ikuti aturan yang sama yang ditetapkan dalam teks "
Penyeimbangan redoks”, namun, hanya dengan satu perubahan: penentuan variasi Nox (∆Nox) dari spesies yang menghasilkan dua oksidasi (SnS) akan menjadi jumlah dari dua Nox, yang akan memberi kita nilai total elektron yang hilang:- SnS: Total Nox = (∆Nox SnCl4) + (∆Nox S)
SnS: Jumlah NOx = 2 + 2 = 4
- HNO3: Nox = 3
Jadi, kita dapat melanjutkan dengan langkah-langkah berikut untuk menyeimbangkan:
Jangan berhenti sekarang... Ada lagi setelah iklan ;)
- SnS: Jumlah NOx = 4 → 4 akan menjadi koefisien HNO3;
- HNO3: Nox = 3 → 3 akan menjadi koefisien SnS.
3 SnS + HCl + 4 HNO3 → SnCl4 + S + TIDAK + H2HAI
Melanjutkan penimbangan dengan metode percobaan:
- Karena Anda memiliki 3 Sn dan 3 S di anggota pertama, ini juga akan menjadi koefisien Anda di anggota ke-2:
3 SnS + HCl + 4 HNO3 → 3 SnCl4 + 3 Y+TIDAK+H2HAI
- Dengan itu, anggota ke-2 yang tersisa dengan 12 Cl (3. 4 = 12), jadi 12 adalah koefisien zat yang mengandung Cl pada anggota pertama, yaitu HCl:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + TIDAK + H2HAI
- Kami sekarang memiliki 16 H di anggota pertama (12 + 4 = 16), maka koefisien H2O akan sama dengan 8, karena 8 dikalikan dengan indeks hidrogen, yaitu 2, menghasilkan 16:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + TIDAK +8H2HAI
- Selanjutnya, di anggota 1 juga ada 4 N, jadi 4 juga akan menjadi koefisien N di anggota ke-2:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + 4 TIDAK +8 H2HAI
Perhatikan bahwa jumlah oksigen pada ekstremitas pertama (3. 4 = 12) sama dengan jumlah total elemen itu di tungkai ke-2 (4 + 8 = 12). Jadi reaksinya seimbang.
Oleh Jennifer Fogaa
Lulus kimia
Apakah Anda ingin mereferensikan teks ini di sekolah atau karya akademis? Lihat:
FOGAÇA, Jennifer Rocha Vargas. "Reaksi dengan lebih dari satu oksidasi dan/atau reduksi"; Sekolah Brasil. Tersedia di: https://brasilescola.uol.com.br/quimica/reacoes-com-mais-uma-oxidacao-ou-reducao.htm. Diakses pada 27 Juli 2021.


