Kinetika kimia mempelajari kecepatan reaksi kimia dan faktor-faktor yang mempengaruhi laju reaksi tersebut.
Gunakan pertanyaan di bawah ini untuk menguji pengetahuan Anda dan lihat komentar pada resolusi.
pertanyaan 1
Mengenai faktor-faktor yang mempengaruhi kecepatan reaksi kimia, adalah SALAH untuk menyatakan bahwa:
a) Semakin tinggi konsentrasi reaktan, semakin cepat reaksi.
b) Semakin besar permukaan kontak, semakin besar kecepatan reaksi.
c. Semakin tinggi tekanan, semakin cepat reaksi.
d) Semakin tinggi suhu, semakin cepat reaksi.
e) Adanya katalis membuat laju reaksi tetap konstan.
Alternatif yang salah: e) Adanya katalis membuat laju reaksi tetap konstan.
Katalis meningkatkan kecepatan reaksi, karena mereka memfasilitasi pembentukan kompleks teraktivasi antara reaktan.
Dengan ini, katalis menciptakan mekanisme yang lebih pendek untuk reaksi berkembang, menyebabkan kecepatan meningkat.
pertanyaan 2
Menurut _____________ tumbukan efektif harus terjadi antara reagen untuk pembentukan produk. Selain itu, ada cukup ___________ untuk memutuskan ikatan kimia reaktan dan membentuk ___________, yang merupakan keadaan antara sebelum pembentukan produk.
Kata-kata yang mengisi titik-titik dengan benar adalah:
a) entalpi, energi kinetik dan variasi katalis.
b) teori tumbukan, energi aktivasi dan kompleks teraktivasi.
c) kecepatan reaksi, entalpi dan inhibitor.
d) tekanan parsial, entropi dan substrat.
Alternatif yang benar: b) teori tumbukan, energi aktivasi dan kompleks teraktivasi.
Menurut teori tumbukan, tumbukan antara reaktan diperlukan agar reaksi kimia dapat terjadi. Untuk ini, zat harus berada dalam posisi yang menguntungkan agar guncangan menjadi efektif.
Energi aktivasi bertindak sebagai penghalang energi yang harus diatasi untuk memutuskan ikatan senyawa yang bereaksi. Semakin rendah energi aktivasi, semakin cepat reaksi.
Kompleks teraktivasi adalah spesies antara yang tidak stabil yang terbentuk sebelum produk.
pertanyaan 3
Empat pernyataan berikut dibuat tentang katalis:
SAYA. Katalis bekerja dengan meningkatkan kecepatan reaksi, tetapi tidak mengubah kinerjanya.
II. Dalam reaksi kimia katalis tidak dikonsumsi di jalur reaksi.
AKU AKU AKU. Katalis menciptakan rute alternatif untuk mengubah reaktan menjadi produk. Untuk ini, diperlukan energi aktivasi yang lebih besar.
IV. Katalis hanya mampu mempercepat reaksi ke arah depan.
Opsi yang menyajikan informasi yang benar tentang katalis adalah:
a) I dan II
b) II dan III
c) I dan IV
d) Semua
Alternatif yang benar: a) I dan II.
Katalis digunakan untuk mempercepat reaksi kimia. Reaksi menggunakan katalis tidak mengubah hasilnya, yaitu jumlah produk yang diharapkan dihasilkan, tetapi dalam waktu yang lebih singkat.
Katalis tidak dikonsumsi selama reaksi kimia, mereka membantu dalam pembentukan kompleks teraktivasi. Oleh karena itu, katalis dapat diperoleh kembali pada akhir reaksi kimia.
Katalis mampu mengurangi waktu reaksi dengan menciptakan mekanisme alternatif untuk pembentukan produk dengan energi aktivasi yang lebih rendah. Oleh karena itu, reaksi berlangsung lebih cepat.
Katalis bekerja baik dalam arah maju maupun berlawanan arah reaksi.
pertanyaan 4
Seberapa cepat reaksi kimia berlangsung tergantung pada:
SAYA. Jumlah tumbukan efektif antara reagen.
II. Energi yang cukup untuk mengatur ulang atom.
AKU AKU AKU. Orientasi molekul yang menguntungkan.
IV. Pembentukan kompleks teraktivasi.
a) I dan II
b) II dan IV
c) I, II dan III
d) I, II, III dan IV
Alternatif yang benar: d) I, II, III dan IV.
Tumbukan efektif terjadi ketika reaktan berada dalam posisi yang menguntungkan untuk guncangan, yang akan mendorong penataan ulang atom.
Energi aktivasi harus cukup untuk tumbukan antara reaktan yang menghasilkan pemutusan ikatan dan pembentukan kompleks teraktivasi.
Tidak semua tumbukan antar partikel yang bereaksi menyebabkan reaksi berlangsung. Orientasi terjadinya tumbukan penting untuk terjadinya pembentukan produk.
Kompleks teraktivasi adalah keadaan antara dan tidak stabil sebelum pembentukan produk. Ini dibuat ketika energi aktivasi untuk reaksi terlampaui.
pertanyaan 5
Karbon dioksida adalah gas yang terbentuk dari reaksi antara karbon monoksida dan gas oksigen, menurut persamaan kimia di bawah ini.
BERSAMA(g) +2 (g) → CO2 (g)
Diketahui bahwa dalam 5 menit reaksi, 2,5 mol CO dikonsumsi, berapa laju perkembangan reaksi menurut konsumsi O2?
a) 0,2 mol. min-1
b.1,5 mol. min-1
c.2,0 mol min-1
d) 0,25 mol. min-1
Alternatif yang benar: d) 0,25 mol. min-1
Untuk menjawab pertanyaan ini kita harus melihat persamaan kimia.
BERSAMA(g) +2 (g) → CO2 (g)
Perhatikan bahwa 1 mol karbon monoksida bereaksi dengan mol oksigen membentuk 1 mol karbon dioksida.
Jumlah yang diberikan dalam pernyataan mengacu pada karbon monoksida, tetapi jawabannya harus dalam hal oksigen. Untuk ini kita harus melakukan aturan tiga dan menemukan jumlah oksigen.
1 mol CO - mol O2
2,5 mol CO - x O2
x = 1,25 mol
Sekarang kami menerapkan nilai-nilai dalam rumus untuk laju perkembangan reaksi.
Oleh karena itu, laju perkembangan reaksi terhadap oksigen adalah 0,25 mol.min-1.
pertanyaan 6
Perhatikan representasi grafis dari perkembangan reaksi kimia hipotetis, yang menghubungkan energi dan jalur reaksi.
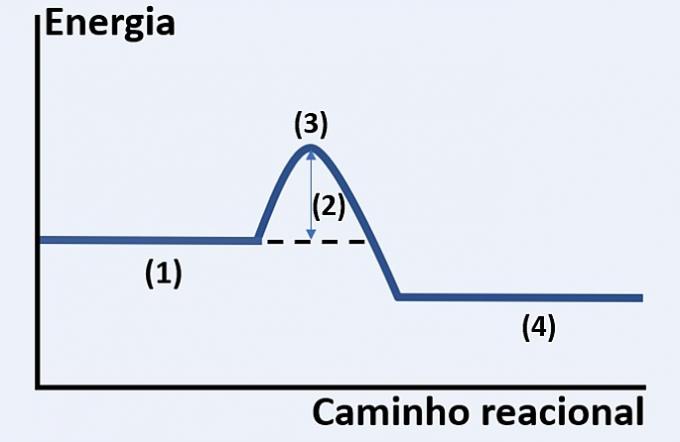
Periksa alternatif yang masing-masing menggantikan (1), (2), (3) dan (4) dengan benar.
a) substrat, panas yang dilepaskan, keadaan energi maksimum dan akhir reaksi.
b) reagen, energi aktivasi, kompleks teraktivasi dan produk.
c) reaktan, energi kinetik, katalis dan substrat.
d) reaktan, panas yang diserap, energi panas dan produk.
Alternatif yang benar: b) reagen, energi aktivasi, kompleks teraktivasi dan produk.
Grafik yang ditunjukkan adalah reaksi endoterm, yaitu ada penyerapan energi agar reaksi dapat terjadi.
Kamu reagen (1) berada di awal grafik dan energi aktivasi (2) sesuai dengan perbedaan antara energi yang tersimpan dalam reaktan dan kompleks teraktivasi (3). Akhirnya, setelah melewati keadaan antara, pembentukan produk (4).
Oleh karena itu, reaktan perlu mengatasi energi aktivasi untuk mengatur ulang atomnya menjadi struktur perantara yang disebut kompleks teraktivasi agar produk dapat terbentuk.
pertanyaan 7
Zat A mampu terurai dan menjadi zat B. Amati perkembangan reaksi ini pada gambar di bawah ini.

Mengenai kecepatan reaksi, kita dapat mengatakan bahwa:
a) Zat A terurai antara 0 dan 15 s dengan laju 0,35 mol.s-1.
b) Zat A terurai antara 15 dan 30 detik dengan laju 0,02 mol.s-1.
c) Zat A terurai antara 0 dan 15 s dengan laju 0,04 mol.s-1.
d) Zat A terurai antara 15 dan 30 detik dengan laju 0,03 mol.s-1.
Alternatif yang benar: d) Zat A terurai antara 15 dan 30 detik dengan laju 0,03 mol.s-1.
Laju penguraian zat A dapat dihitung dengan rumus:
Mari kita hitung kecepatan reaksi dalam hal zat A antara interval yang diberikan.
Rentang antara 0 dan 15:
Rentang antara 15 dan 30:
Oleh karena itu, alternatif d benar, karena zat A terurai antara 15 dan 30 detik dengan laju 0,03 mol.s.-1.
pertanyaan 8
Perhatikan reaksi hipotetis berikut.
aA + bB → cC + dD
Perhatikan variasi konsentrasi A dan C di bawah ini.
| Waktu) | 0 | 5 | 10 | 15 | 20 | 25 |
|---|---|---|---|---|---|---|
| Konsumsi A (mol/L) | 7,5 | 6,0 | 4,5 | 3,0 | 2,5 | 1,0 |
| Pembentukan C (mol/L) | 0 | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 |
Berdasarkan informasi yang diberikan dalam pertanyaan, berapakah laju konsumsi A dan laju pembentukan C dalam selang waktu antara 5 dan 25 menit?
a) 0,3 mol. L-1.s-1 dan 0,1 mol. L-1.s-1
b) - 0,1 mol. L-1.s-1 dan 0,3 mol. L-1.s-1
c) - 0,25 mol. L-1.s-1 dan 0,1 mol. L-1.s-1
d) 0,1 mol. L-1.s-1 dan 0,3 mol. L-1.s-1
Alternatif yang benar: c) - 0,25 mol. L-1.s-1 dan 0,1 mol. L-1.s-1.
Tingkat konsumsi:
C tingkat pelatihan:
Oleh karena itu, dalam reaksi, A dikonsumsi pada laju 0,25 mol.s-1, sehingga nilainya negatif, sedangkan B terbentuk pada laju 0,1 mol. L-1.s-1.
Baca juga:
- Kinetika Kimia
- Kimia panas
- Keseimbangan kimia
- Reaksi kimia