Eksperimen adalah cara praktis untuk mempelajari dan menguji pengetahuan Anda tentang konsep-konsep yang dipelajari dalam Kimia.
Manfaatkan eksperimen kimia ini, yang dapat dilakukan di rumah (di bawah pengawasan orang dewasa) atau dikerjakan di kelas bersama guru, untuk melengkapi pelajaran Anda.
Pengalaman pertama - mengungkap warna
Konsep yang terlibat: kromatografi dan pemisahan campuran
Bahan:
- pena (spidol bertanda) berbagai warna
- alkohol
- kertas saring kopi
- cangkir (gelas untuk memudahkan pemantauan percobaan)
Bagaimana membuat
- Gunakan gunting dan potong kertas saring. Untuk setiap pena yang digunakan, buat persegi panjang.
- Sekarang, pada jarak kira-kira 2 cm dari alas, gambar lingkaran dengan pena warna pilihan Anda dan cat semua bagian dalamnya.
- Rekatkan tepi kertas terjauh dari marmer yang ditarik ke penyangga. Untuk ini, Anda dapat menggunakan selotip dan menempelkannya pada pensil.
- Tambahkan alkohol ke cangkir, jangan terlalu banyak, karena seharusnya hanya menyentuh ujung kertas di dekat tanda pena.
- Tempatkan kertas di dalam cangkir sehingga vertikal. Pensil yang menopangnya harus diletakkan di tepinya.
- Tunggu antara 10 dan 15 menit hingga alkohol naik melalui kertas saring. Setelah itu, keluarkan kertas dan biarkan mengering.
Hasil
Ketika alkohol melewati tanda pena, ia berinteraksi dengan komponen warna dan mendorongnya melintasi kertas. Dengan demikian, pigmen yang berbeda akan dipisahkan dengan kontak dengan alkohol.
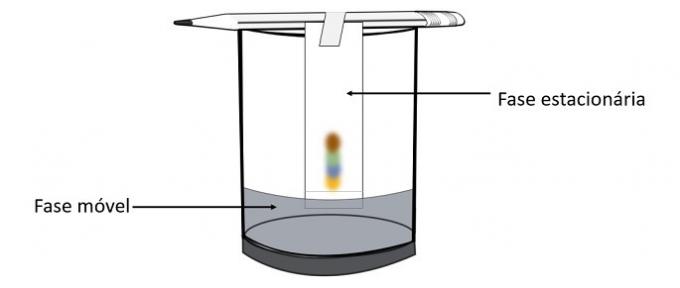
Melalui percobaan ini dimungkinkan untuk mengetahui warna mana yang dicampur untuk menciptakan warna pena.
Penjelasan
Kromatografi merupakan salah satu jenis proses pemisahan campuran. Kertas saring adalah fase diam dan alkohol adalah fase gerak yang menyeret komponen campuran saat melewati fase diam. Dalam proses ini, semakin besar interaksi dengan alkohol, semakin cepat pigmen akan bergerak dengan lewatnya pelarut.
Konstituen bahan, karena memiliki sifat yang berbeda, akan berinteraksi dengan fase gerak dengan cara yang berbeda, yang dapat diperhatikan oleh waktu seret yang berbeda dalam fase diam.
Belajar lebih tentang kromatografi.
Pengalaman ke-2 - pengawetan makanan
Konsep yang terlibat: senyawa organik dan reaksi kimia
Bahan:
- apel, pisang atau pir
- jus lemon atau jeruk
- Vitamin C tablet
Bagaimana membuat
- Pilih salah satu dari tiga buah dan potong menjadi 3 bagian yang sama.
- Bagian pertama akan berfungsi sebagai perbandingan dengan yang lain. Jadi jangan menambahkan apa pun ke dalamnya, biarkan saja terkena udara.
- Ke dalam salah satu bagian, teteskan isi lemon atau jeruk. Oleskan sehingga seluruh bagian dalam buah tertutup jus.
- Pada bagian terakhir, olesi vitamin C, bisa berupa tablet yang dihancurkan, ke seluruh ampas buah.
- Perhatikan apa yang terjadi dan bandingkan hasilnya.
Hasil
Daging buah yang terkena udara harus cepat menggelap. Jus lemon atau jeruk dan vitamin C, bahan kimia yang disebut asam askorbat, akan memperlambat pencoklatan buah.

Penjelasan
Saat kita memotong buah, sel-selnya rusak melepaskan enzim seperti polifenol oksidase, yang di kontak dengan udara mengoksidasi senyawa fenolik yang ada dalam makanan dan menyebabkan pencoklatan enzimatik.
Untuk mencegah aksi oksigen, pengawet seperti asam askorbat digunakan karena mereka lebih disukai teroksidasi menggantikan senyawa fenolik. Selain tablet vitamin C, asam askorbat juga hadir dalam sumber alami, seperti jeruk, lemon dan jeruk, disarankan dalam percobaan.
Belajar lebih tentang oksidasi.
Pengalaman ke-3 – siapa yang lebih cepat membeku?
Konsep yang terlibat: sifat koligatif dan cryoscopy
Bahan:
- dua tabung (digunakan untuk bantuan pesta)
- mangkuk kaca
- garam dapur
- air yang disaring
- Es
- termometer
Bagaimana membuat
- Tambahkan jumlah yang sama dari air yang disaring ke kedua tabung. Misalnya, 5 mL di setiap tabung.
- Tambahkan garam meja ke salah satu tabung dan letakkan pita identifikasi untuk membedakan mana yang asin.
- Isi wadah kaca dengan es serut dan tambahkan sedikit garam.
- Tempatkan kedua tabung secara bersamaan di dalam es dan perhatikan apa yang terjadi.
- Catat suhu beku untuk setiap situasi.
Hasil
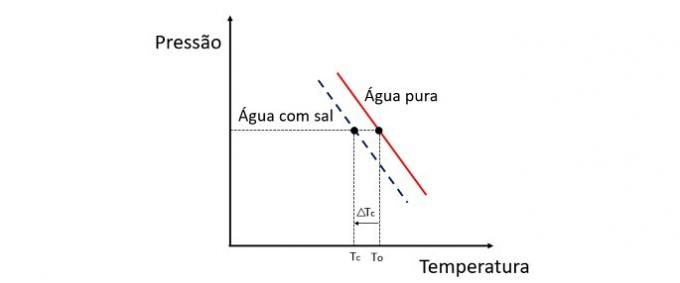
Menambahkan zat terlarut ke dalam air menurunkan suhu beku. Oleh karena itu, air biasa cenderung membeku lebih cepat daripada larutan garam dan air ketika terkena kondisi yang sama.
Penjelasan
Krioskopi adalah sifat koligatif yang mempelajari variasi suhu pelarut ketika jumlah zat terlarut yang berbeda dilarutkan di dalamnya.
Menurunkan suhu beku air disebabkan oleh zat terlarut yang tidak mudah menguap dan fenomena ini memiliki banyak aplikasi praktis. Oleh karena itu, semakin besar konsentrasi zat terlarut dalam larutan mempengaruhi efek cryoscopic.
Jika, misalnya, air membeku pada 0 °C dan kita menambahkan garam ke dalamnya, suhu perubahan fase akan negatif, yaitu jauh lebih rendah.
Inilah sebabnya mengapa air laut tidak membeku di tempat yang suhunya di bawah 0 °C. Garam yang dilarutkan dalam air cenderung lebih menurunkan suhu beku. Di tempat-tempat yang bersalju, biasanya juga membuang garam ke jalan untuk mencairkan es dan menghindari kecelakaan.
Belajar lebih tentang sifat koligatif.
Eksperimen ke-4 - dekomposisi hidrogen peroksida
konsep yang terlibat: reaksi kimia dan katalis
Bahan:
- Setengah kentang mentah dan setengah matang
- Sepotong hati mentah dan sepotong matang lainnya
- Hidrogen peroksida
- 2 piring
Bagaimana membuat
- Di setiap hidangan tambahkan makanan, kentang bersama dan hati bersama.
- Di masing-masing dari empat bahan tambahkan 3 tetes hidrogen peroksida.
- Perhatikan apa yang terjadi dan bandingkan hasilnya.
Hasil
Hidrogen peroksida, larutan hidrogen peroksida, ketika bersentuhan dengan makanan mentah, mulai berbuih hampir seketika.
Eksperimen ini juga dapat dilakukan dengan menambahkan sepotong makanan ke dalam wadah berisi hidrogen peroksida agar reaksi lebih terlihat.
Penjelasan
Buih yang disajikan oleh hidrogen peroksida ketika bersentuhan dengan makanan mentah mencirikan terjadinya reaksi kimia, yaitu penguraian hidrogen peroksida dan pelepasan gas oksigen.
Dekomposisi hidrogen peroksida terjadi melalui aksi enzim katalase, yang ditemukan di organel peroksisom, yang ada pada sel hewan dan tumbuhan.
Penting untuk dicatat bahwa dekomposisi hidrogen peroksida terjadi secara spontan, dengan adanya sinar matahari, tetapi dalam reaksi yang sangat lambat. Namun, katalase bertindak sebagai katalis, meningkatkan kecepatan reaksi kimia.
Hidrogen peroksida dapat menjadi zat beracun bagi sel. Oleh karena itu, katalase memecah senyawa dan menghasilkan air dan oksigen, dua zat yang tidak membahayakan tubuh.
Saat makanan dimasak, komponennya mengalami perubahan. Modifikasi yang disebabkan oleh pemasakan juga mengganggu kerja katalase dengan mendenaturasi protein.
Tindakan yang sama yang kita lihat dengan makanan adalah apa yang terjadi ketika kita mengoleskan hidrogen peroksida pada luka. Katalase bertindak dan ada pembentukan gelembung, yang terdiri dari pelepasan oksigen.
Belajar lebih tentang reaksi kimia.
Referensi bibliografi
SAINTA, W. L hal.; MOL, G. S (Koordinat.). Kimia Warga. 1. ed. So Paulo: Generasi Baru, 2011. v. 1, 2, 3.
MASYARAKAT KIMIA BRASIL (org.) 2010. Kimia di dekat Anda: Eksperimen berbiaya rendah untuk kelas K-12. 1. ed. Sao Paulo.